Принципы структурной организации белков - Г. Шульц 1982
Взаимодействия, определяющие структуру белка
Невалентные взаимодействия были открыты Ван-дер-Ваальсом (1873 г.), пытавшимся объяснить отклонение поведения реального газа от закона идеального газа. Взаимодействия между валентнонесвязанными атомами имеют огромное значение для биологических организмов; в частности, они ответственны за спонтанное свертывание полипептидных цепей и цепей нуклеиновых кислот, а также спонтанное образование мембран. Благодаря им происходит узнавание комплементарных молекулярных поверхностей («система ключ — замок») [44]).
Типы различных невалентных взаимодействий перечислены в табл. 3.1; их энергия на один-три порядка меньше по абсолютной величине энергии ковалентного связывания. Величину невалентных взаимодействий трудно измерить и столь же трудно рассчитать. Кроме того, в стабилизацию белка важный вклад энтропийного характера вносит окружающая среда. Поэтому необходимо рассматривать систему в целом, учитывая белок и растворитель.
Таблица 3.1 Типы взаимодействий, важных для белковых структурa
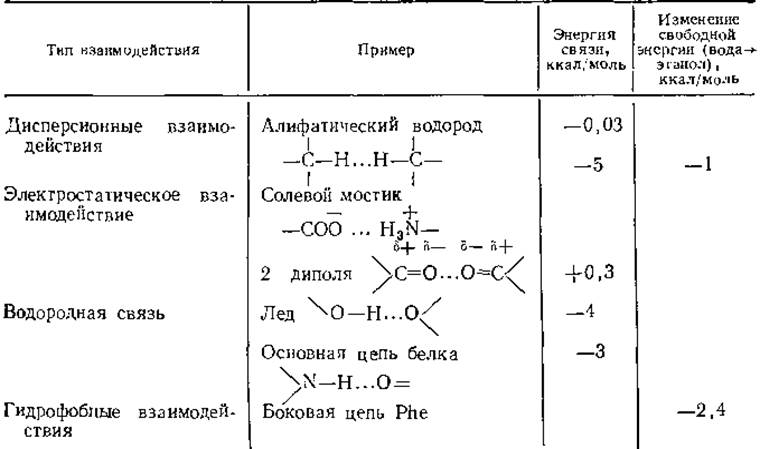
а При расчетах энергии электростатического взаимодействия диэлектрическая проницаемость принята равной 4.