Принципы структурной организации белков - Г. Шульц 1982
Взаимодействия, определяющие структуру белка
Дисперсионные силы и отталкивание электронных оболочек
Дисперсионные силы притяжения действуют между любыми парами атомов. Дисперсионные силы существуют между любой парой атомов, даже если они совершенно неполярны. Если представить атом осциллирующим диполем, то в паре атомов каждый диполь будет поляризовать соседний атом. В результате между атомами возникнет сила притяжения, энергия которой в первом приближении обратно пропорциональна шестой степени расстояния между ядрами атомов [45] и пропорциональна поляризуемостям атомов [46].
Поляризуемость входящего в молекулу атома анизотропна, в связи с чем дисперсионные силы зависят от ориентации фрагментов молекулы друг относительно друга. Однако поскольку влияние ориентации мало и его трудно измерить, то им обычно пренебрегают и считают дисперсионные силы изотропными.
Электронные оболочки валентно-несвязанных атомов взаимно отталкиваются. Силы дисперсионного притяжения между парой валентно-несвязанных атомов уравновешиваются отталкиванием электронных оболочек. Это отталкивание было аппроксимировано Леннард-Джонсом введением слагаемого, обратно пропорционального m-й степени расстояния [47]. Слейтер [48] описал отталкивание экспоненциальной функцией, которая была модифицирована Букингемом [49] и носит его имя. В расчетах белков наиболее часто используют аппроксимацию Леннард-Джонса с m = 12. С учетом лондоновского члена для дисперсионных сил [45] это приводит к простому в вычислительном отношении потенциалу 6—12, пример которого приведен на рис. 3.1. Оба параметра, необходимых для определения этой функции, описаны в подписи к Рисунку. Потенциал на рис. 3.1 имеет минимум в отрицательной области при расстоянии Rm. Поэтому атомы слабо «связаны» на этом расстоянии (Еm — энергия притяжения).
Энергетические параметры могут быть определены из данных по кристаллическим структурам. Абсолютную величину параметров потенциала 6—12 Леннард-Джонса можно определить по контактным расстояниям и контактным энергиям в кристаллах малых молекул, которые следуют из данных рентгеноструктурного анализа и, например, теплот сублимации. Эти же данные можно получить из экспериментов по рассеянию атомных и молекулярных пучков.
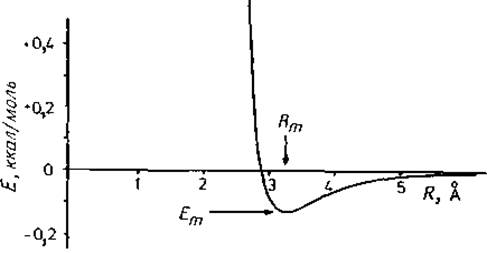
Рис. 3.1. Потенциал 6—12 Леннард-Джонса, описывающий дисперсионные силы и электронное отталкивание (Rm = 3,24 Å, Еm = —0,13 ккал/моль).
Формула с двумя параметрами дана ниже в удобной для вычисления форме (A, В — параметры), а также в ее нормированном виде (Em, Rm— параметры); величины А b В положительны. С уменьшением В и увеличением А Еm уменьшается, а соответствующее межатомное расстояние Rm увеличивается. Потенциальный барьер асимметричен. Отталкивание и притяжение взаимно уравновешиваются при расстоянии 0,89∙Rm; на расстоянии 1,5∙Rm энергия притяжения составляет всего одну шестую Еm.
![]()
Примеры таких параметров даны в табл. 3.2. Различия между данными характеризуют величину возможных ошибок.
Как видно из табл. 3.2, доля энергии, приходящаяся на атомный контакт, очень мала. Однако количество контактов в белке велико. Например, при плотнейшей гексагональной упаковке одинаковых сфер каждая сфера образует контакты с 12 соседями. Поскольку контактные энергии складываются аддитивно, то общая энергия притяжения, приходящаяся на сферу, в этом случае в шесть раз больше энергии, приходящейся на один контакт.
Таблица 3.2 Параметры потенциала 6—12 Леннард-Джонса для отталкивания электронных оболочек и дисперсионных сил при невалентном контакте а
|
Взаимодействие |
Данные Момани и сотр. [69] |
Данные Лифсоиа и Уоршела [70, 71] |
||
|
Em, ккал/моль |
ккал/моль |
Rm, Å |
||
|
Алифатический Н ... алифатический Н Алифатический С ... алифатический С Карбонильный О ... карбонильный ... О Амидный N ... амидный N |
—0,04 —0,04 —0,20 —0,11 |
2,92 4,12 3,12 3,51 |
—0,01 —0,19 —0,23 —0,19 |
2,94 4,23 3,00 3,60 |
а Приведены контакты только между идентичными типами атомов. Для контакта между неидентичными типами i и j получаем ![]()
![]()