Принципы структурной организации белков - Г. Шульц 1982
Взаимодействия, определяющие структуру белка
Водородные связи
Водородные связи — преимущественно электростатические взаимодействия. Как было показано, межатомные расстояния, отвечающие всем невалентным контактам атомов, приблизительно описываются соответствующими вандерваальсовыми радиусами. Это правило часто нарушается в случае контактов, образованных атомами водорода. Например, расстояние между амидным атомом Н и карбонильным атомом О составляет всего 1,9 Å, вместо 2,7 Å, получающихся из расчета по вандерваальсовым радиусам из табл. 3.6. Опыт показывает, что этот эффект наблюдается всегда, когда атом Н несет большой положительный парциальный заряд, а его партнер по контакту — большой отрицательный парциальный заряд (табл. 3.3). Эти заряды притягивают друг друга. Поскольку все электронное облако атома водорода (у водорода только один электрон!) сильно смещено к атому, с которым водород ковалентно связан, отталкивание оболочек контактирующих партнеров мало и притяжение зарядов может их еще более сблизить. Такое короткое расстояние обусловливает большую величину кулоновской энергии притяжения (табл. 3.4), а также высокую дисперсионную энергию [56]. Энергия взаимодействия имеет в этом случае значение, промежуточное по абсолютной величине между энергией вандерваальсовых контактов и энергией ковалентных связей. Такие контакты были выделены в особую группу «водородных связей», а атомы, участвующие в связи, получили название «донор — акцептор водородной связи».
Биологически важные водородные связи не приводят к большому перекрыванию волновых функций. Полемичен вопрос относительно существенности вклада в водородную связь перекрывания волновых функций [56]. В предельном случае иона [F . . . Н—F]- такое перекрывание несомненно имеется. В этом случае расстояние F—F составляет всего 65% суммы вандерваальсовых радиусов атомов Н и F и длины связи Н—F, а связывающая энергия (~50 ккал/моль) приближается к энергии ковалентных связей [57]. Однако в белках расстояния и связывающая энергия уменьшаются не так. Здесь вклад перекрывания волновых функций, по-видимому, значительно несуществен.
Таблица 3.7 Водородные связи в белках [58]
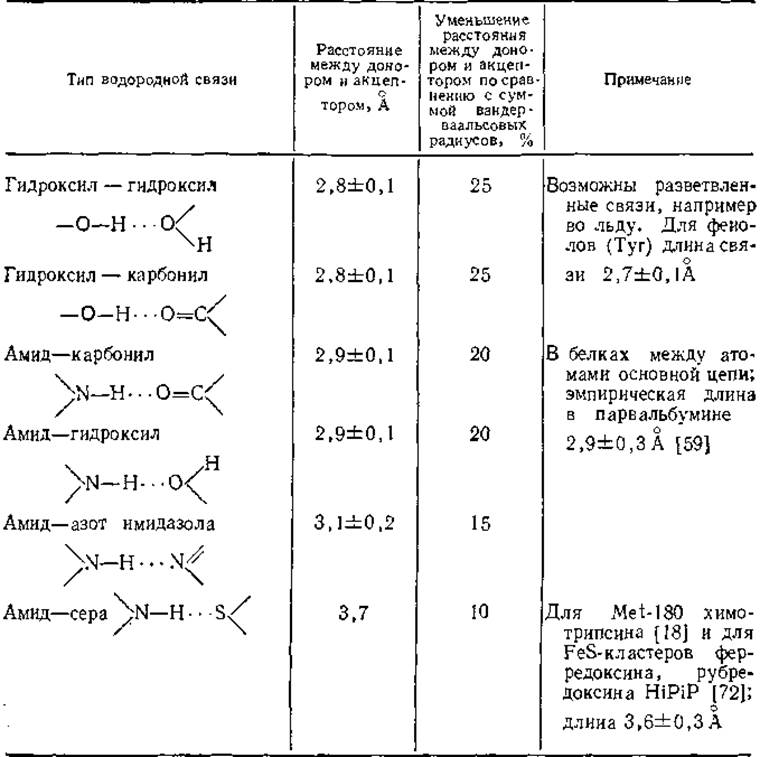
Длина водородной связи пропорциональна ее энергии. Как видно из табл. 3.7, самые малые длины и самые высокие энергии найдены в водородных связях с участием атома кислорода, в частности между фенольными группами (Туr—Туr) и в воде. Несколько большие расстояния и меньшие энергии у водородных связей между атомами азота и кислорода, и значительно меньшие энергии имеют водородные связи между двумя атомами азота, а также между атомами азота и серы. По сравнению с суммой вандерваальсовых радиусов расстояния увеличиваются на 10—25%. Для грубой оценки энергии водородных связей проще всего воспользоваться теплотой сублимации льда, которая составляет 13 ккал/моль. Большая часть этой теплоты приходится на водородные связи, поскольку теплоты сублимации H2S и H2Se (которые образуют значительно более слабые водородные связи) составляют всего 6 ккал/моль. Как показано на рис. 3.2, на молекулу Н2О приходятся две водородные связи, так что энергия одной водородной связи должна быть несколько больше половины разности теплот сублимации, а именно около 4 ккал/моль. Энергия водородных связей между амидной и карбонильной группами, которые часто образуются в основной цепи полипептидов, составляет около 3 ккал/моль (табл. 3.1).
Водородные связи линейны. Как упоминалось в предыдущем разделе, водородная связь включает большой положительный (Н-атом) и большой отрицательный (Н-акцептор) парциальные заряды, которые разделены коротким расстоянием. В общем случае эти заряды можно рассматривать как составляющие диполя (табл. 3.3).
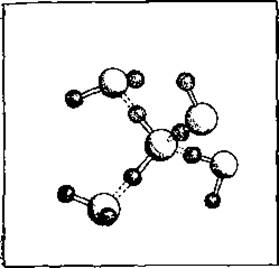
Рис. 3.2. Структура льда по данным рентгеноструктурного анализа и нейтронографии.
Ковалентно связанные соседние атомы (Н-донор и сосед Н-акцептора) несут противоположные заряды, например
![]()
Таким образом, положительно заряженный Н-атом находится между двумя отрицательно заряженными атомами.
Положительный заряд обеспечивает атому Н, расположенному между двумя отрицательными зарядами, наиболее низкую потенциальную энергию, если все три заряда расположены на одной прямой. Как следствие водородные связи линейны, например в связи N—Н • • • О атомы располагаются на одной прямой. Электростатические расчеты показывают, что
![]()
отклонение угла от нуля на 20° понижает энергию связи приблизительно на 10% [58]. В парвальбумине [59] среднее отклонение угла составляет именно 20°. Очевидно, в этой структуре (так же как и в других белковых структурах) устанавливается определенный компромисс между максимальной энергией водородной связи и другими геометрическими ограничениями.
Диполи, составляющие водородную связь, стремятся к линейному расположению. Линейность водородной связи не следует отождествлять с ориентацией составляющих ее диполей, как, например, с линейным расположением пептидного амида и карбонильной группы:
![]()
Как показано в табл. 3.4, диполи имеют минимальную энергию (самая прочная связь), если они ориентированы вдоль прямой*. Однако нарушение этой ориентации приводит к значительно меньшему снижению энергии, чем такое же по величине отклонение от линейности водородной связи [58]. Поэтому нарушение линейной ориентации диполей довольно обычно в белках, где водородные связи подчинены разнообразным геометрическим ограничениям. Для льда также характерно нелинейное расположение диполей (рис. 3.2), а в некоторых случаях, как, например, для связи между амидной и гидроксидной группами, линейная ориентация стерически невозможна (табл. 3.7).