Принципы структурной организации белков - Г. Шульц 1982
Взаимодействия, определяющие структуру белка
Энтропия
Концепция свободной энергии
Связывающая энергия конкурирует в вакууме с энтропией цепи.
До сих пор мы рассматривали только невалентную связывающую энергию, т. е. вандерваальсовы взаимодействия и водородные связи. Однако образование белков и их стабильность зависят от свободной энергии, а не только от связывающей энергии**. Кроме того, поскольку нативные белки находятся в водном окружении, то при строгом подходе необходимо учитывать свободную энергию всей системы, включающей белковую цепь и растворитель.
Чтобы выявить взаимосвязь между свободной энергией и связывающей энергией, рассмотрим вначале полипептидную цепь в вакууме. В этом случае разность свободных энергий свернутого нативного и вытянутого денатурированного состояний равна ∆Gцепь = Gнaн — Gденат, тогда как разность связывающих энергий равна ∆Hцепь = Hнат — Hденат. Константа равновесия К = (число цепей в нативном состоянии)/(число цепей в денатурированном состоянии) задается уравнением
- RTlnK = ∆Gцепь = ∆Hцепь - T∆Sцепь (3.1)
* На малых расстояниях, найденных в водородных связях, диполь — дипольные взаимодействия нельзя сводить к взаимодействию двух точечных диполей, как это сделано в табл. 3.4. Однако формула в табл. 3.4 применима к линейно расположенным диполям.
** Как принято в биологической литературе, под термином «свободная энергия» будет подразумеваться свободная энергия Гиббса. Термин «связывающая энергия» используется для обозначения «(связывающей) энтальпии». В большинстве биологических реакций изменениями объема и объемных энергий пренебрегают, поэтому свободная энергия Гиббса эквивалентна свободной энергии Гельмгольца, а (связывающая) энергия эквивалентна (связывающей) энтальпии.
Правая часть уравнения (3.1) пояснена рис. 3.3, а. Изменение энтропии (беспорядка) ∆Sцепь = Sнaт — Sденат играет решающую роль. Состояние денатурированных полипептидных цепей менее упорядочено (более высокая энтропия), чем состояние нативных цепей, поэтому ∆Sцепь отрицательна и энтропийный член —Т∆Sцепь положителен, что способствует переходу в денатурированное состояние. Величина ∆Hцепь отрицательна поскольку водородные связи и вандерваальсово притяжение увеличивают связывающую энергию нативного состояния, так что Hнат ниже (более отрицательна), чем Hденат. Следовательно, при данной температуре Т знак ∆Gцепь (а значит, величина К) зависит от соотношения абсолютных величин ∆Hцепь и ∆Sцепь: «только при достаточной связывающей энергии цепь стремится выйти из денатурированного состояния и принять нативную конформацию». Кроме того, «чем выше температура, тем выше должна быть связывающая энергия». Более строгий подход к ситуации в вакууме, основанный на статистической механике, дан в приложении и в разд. 8.1.
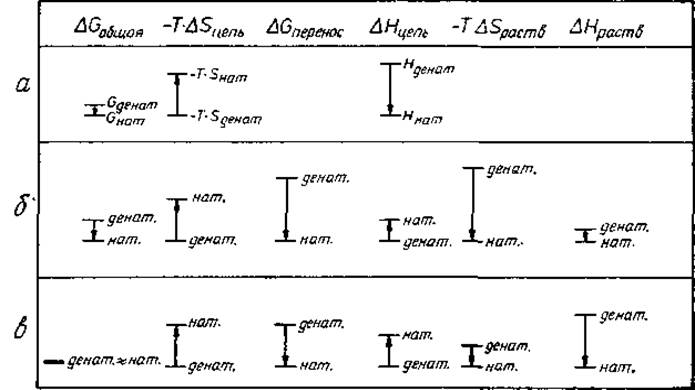
Рис. 3.3. Энергетические вклады в стабильность белка на одну атомную группу. Все значения даны приближенно. Стрелки указывают знаки вкладов: направление вниз означает предпочтительность нативного состояния. При разделении вкладов растворителя и цепи возникает также член, учитывающий энергию взаимодействия растворитель-цепь. Этот член включен В ∆Hцепь. Величины ∆Gобщая и ∆Gперенос определены соответственно уравнениями (3.2) и (3.3). а — полипептидная цепь в вакууме [уравнение (3.1)]. ∆Gобщая благоприятствует нативному состоянию. б — неполярные группы цепи в водном окружении [уравнение (3.2)]. Для системы «масло—вода» индекс «цепь» следует заменить на индекс «масло», в—полярные группы цепи в водном окружении [уравнение (3.2)].
Растворитель очень важен. В применении к вакууму взаимосвязь между связывающей энергией и энтропией очевидна, однако такая ситуация мало связана с реальными биологическими условиями. Белкам необходим растворитель, более того, для стабильности белков предельно важны физические свойства растворителя. Так, почти все белки денатурируются в этаноле или в водных растворах, содержащих достаточные количества додецилсульфата натрия (ДСН) или мочевины. Рассмотрим поэтому систему из полипептидной цепи и растворителя; общая свободная энергия приобретает вид:
— RTlnK = ∆Gобщая = ∆Нцепь + ∆Hраств — T∆Sцeпь — Т∆Spaств (3.2)
Здесь энергия взаимодействия цепи с растворителем включена в чле ∆Hцепь.
Смесь масла и воды
Жидкая вода может образовывать локальные упорядоченные квазикристаллические структуры. Обсудим уравнение (3.2) в применении к водному раствору минерального масла, состоящего из углеводородов, вместо водного раствора полипептидов. «R-состоянием» назовем монодисперсный раствор масла в воде, а «N-состоянием» — раздельные фазы, т. е. каплю масла на поверхности воды. Величина ∆Sмасло отрицательна, поскольку монодисперсный раствор менее упорядочен, чем раздельные фазы (рис. 3.3, б). Величина ∆Hмасло положительна. Чтобы понять этот факт, следует учесть, что в N-состоянии большинство молекул масла окружено такими же молекулами, тогда как в R-состоянии все они окружены водой. В вандерваальсовом взаимодействии между молекулами масла преобладают дисперсионные силы, и поэтому оно слабо. Между молекулами масла и воды это взаимодействие сильнее, поскольку полярные молекулы воды индуцируют в углеводородах диполи, за счет чего заметно растет электростатический член [15]. В связи с этим величина ∆Hмасло (которая представляет разность обоих состояний) благоприятствует образованию монодисперсного раствора. Однако эта величина сравнительно мала.
Экспериментально было показано [15], что величина ∆Spaств положительна, что благоприятствует N-состоянию. Это свидетельствует о том, что упорядоченность водной компоненты выше в монодисперсном растворе масла, где больше площадь контактной поверхности неполярных молекул и молекул воды. У находящейся в таких условиях воды имеются две возможности: либо сохранить свою жидкую структуру и лишиться водородных связей, либо сохранить большую часть водородных связей и образовать вокруг неполярной молекулы локально упорядоченную, так называемую клатратную структуру, или «айсберг» [15]. Первая возможность отвечает увеличению Hраств (уменьшение связывающей энергии), тогда как вторая означает уменьшение Sраств (увеличение упорядоченности). Поскольку наблюдаемая величина ∆Spacтв положительна, вода действительно образует на поверхности раздела локально упорядоченную квазикристаллическую структуру. Но даже при возникновении такой клатратной структуры вода лишается части водородных связей, что приводит к отрицательной величине ∆Hраств, благоприятствующей N-состоянию. Заметим, однако, что абсолютная величина ∆Hраств сравнительно мала.
Энтропия воды способствует образованию капелек масла. Как мы установили, ∆Hмасло и ∆Sмасло благоприятствуют R-состоянию, тогда как ∆Hраств и ∆Spacтв благоприятствуют N-состоянию. Поскольку разделение фаз масла и воды наблюдается в действительности, вклад последних величин превышает вклад первых. Поскольку величина ∆Hраств мала, основной «движущей силой», которая переводит молекулы масла в отдельную фазу или в каплю масла, является ∆Spacтв. Влияние ∆Sраств часто называют «энтропийными силами» или «гидрофобными силами». Эти энтропийные силы приводят также к спонтанному образованию мицелл, пузырьков и мембран из дифильных липидов.
Полипептидная цепь в воде
Природная полипептидная цепь включает специфическую последовательность полярных и неполярных групп. Рассмотрим теперь, пользуясь моделью вода — масло, полипептидную цепь в воде (рис. 3.3). Поверхность контакта полипептидной цепи и воды велика для беспорядочно вытянутой цепи и мала в ее нативной, свернутой конформации. Однако в отличие от совершенно неполярных молекул масла полипептидная цепь включает как полярные, так и неполярные группы. Например, амидные и карбонильные группы основной цепи, а также гидроксильные (в Ser, Thr, Tyr), карбоксильные (в Asp, Glu), аммониевые (в Lys) группы полярны и стремятся оставаться в воде (гидрофильность). Углеводородные боковые цепи Ala, Val, Leu, Не и Phe неполярны.
На первый взгляд белки напоминают капли масла. Как было показано на примере системы масло — вода, все неполярные группы стремятся соединяться, чтобы уменьшить площадь поверхности между неполярной цепью и водой. Действительно, в нативных белках большая часть неполярных боковых групп удалена от воды и сосредоточена в гидрофобных ядрах. Это дало основание Козману [15] сравнивать белки с каплями масла.
Внутренняя часть белка также содержит много полярных групп.
Поскольку глобулярные белки имеют диаметр около 30 Å, боковые цепи не могут располагаться внутри белка без того, чтобы там не находились также полярные амидные и карбонильные группы основной цепи. Однако полярные группы прекрасно сосуществуют с водой, и их локализация во внутренней части без потери свободной энергии возможна, только если они образуют водородные связи. В действительности такие связи наблюдаются для более чем 90% полярных групп, расположенных внутри белка.
Заряженные группы находятся на поверхности. Удаление заряженных групп (Asp, Glu, Lys, Arg) от воды энергетически очень невыгодно. Это может произойти только при сопутствующем образовании солевых мостиков, которые, однако, встречаются крайне редко. Почти все заряженные боковые группы находятся на поверхности белка, увеличивая его растворимость. Кроме того, находясь в растворе в процессе спонтанного свертывания и после него, они способствуют вполне определенному направлению свертывания полипептидной цепи.
Энтропия растворителя вносит большой вклад в стабильность белка. Обсудим теперь четыре члена уравнения (3.2). Как было отмечено выше, величина ∆Sцепь отрицательна для всех частей полипептидной цепи. Для неполярных частей абсолютные величины ∆Hцепь и ∆Hраств малы, причем ∆Hцепь положительна, а ∆Hраств отрицательна (рис. 3.3, б). Для неполярных частей ∆Spacтвимеет большое положительное значение.
Полярные группы образуют водородные связи при контакте с водой и между собой внутри белка. В нашей системе подсчета (все взаимодействия между цепью и растворителем включены в величину Нцепь) величина ∆Нцепь положительна: одна водородная связь с водой рвется и только половина водородной связи образуется внутри белка. Величина ∆Нраств отрицательна: на полярную группу приходится половина водородной связи. На рис. 3.3, в абсолютная величина ∆Нцепь показана меньшей, чем абсолютная величина ∆Нраств, поскольку в плотно упакованной внутренней части белка имеется больше вандерваальсовых контактов (разд. 3.6), чем на поверхности цепь — растворитель. Это благоприятствует нативному N-состоянию. Поскольку молекулы воды отчасти упорядочены вокруг полярных групп, ∆Spacтвположительна, хотя и мала. В целом ∆Gобщая для полярных групп близка к нулю. Сопоставляя все члены уравнения (3.2) (рис. 3.3, б, в) можно заключить, что ∆Spacтв неполярной группы вносит самый большой вклад в стабильность белка. Большой вклад ∆Нраств для полярных групп на рис. 3.3, в значительной степени компенсируется величиной ∆Нцепь. Абсолютная величина ∆Нраств — всего лишь артефакт нашей системы подсчета, которая включает в величину Нцепь взаимодействия растворитель — цепь.
Свободные энергии переноса боковых цепей дают возможность оценить вклады этих цепей в стабильность белка. Количественно оценить обсуждавшиеся выше вклады довольно сложно. В работе [15] были определены величины ∆Н и ∆S переноса различных малых неполярных молекул из монодисперсного водного раствора в монодисперсный раствор в неполярном углеводородном растворителе. Если проводить аналогию между этими экспериментами и переходом неполярных боковых цепей из воды во внутреннюю часть белка, то
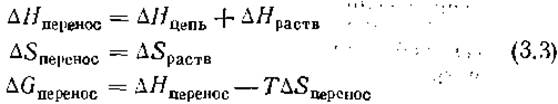
Было установлено, что величина ∆Hперенос мала и положительна, а величина ∆Sперенос велика и положительна, как и следует из обсуждавшегося ранее примера масло — вода. Нозаки и Танфорд 116] определили величины ∆Gпepeнoc для переноса боковых цепей канонических аминокислот из воды в этанол или диоксан, которые имитируют полярность внутренней части белка лучше, чем углеводородные растворители. Не предпринималось никаких попыток разделить значения ∆Еперенос и ∆Sпepeнoc. Некоторые из этих данных приведены на рис. 1.8. Все гидрофобные боковые цепи имеют отрицательные значения ∆Gпepeнoc, что указывает на их стремление избежать водного окружения. Напротив, остаток глицина имеет ∆Gпepeнoc около нуля. Таким образом, основная цепь молекулы (у Gly нет боковой цепи) не отдает предпочтения ни внутренней части, ни поверхности белка.
Величина ∆Gперенос пропорциональна контактной поверхности. Линейная зависимость между площадью доступной поверхности неполярной боковой цепи и величиной ∆Gпepeнoc согласуется с гипотезой «айсберга», поскольку можно ожидать, что число упорядоченных молекул воды пропорционально поверхности контакта. Как видно из рис. 1.8, на каждый диполь приходится уменьшение абсолютной величины ∆Gпepeнoc примерно на 1,5 ккал/моль. Однако эта величина была определена для переноса в этанол или диоксан, где водородные связи не столь прочны, как во внутренней части белка. В случае белка внутренние водородные связи частично компенсируют это уменьшение и значения для более полярных боковых цепей, например Thr и Туr, находятся, как видно из рис. 1.8, ближе к прямой неполярных остатков. Таким образом, выигрыш В ∆Gпepeнoc примерно одинаков для полярных и неполярных групп, а величина ∆Gпepeнoc приблизительно пропорциональна общей площади доступной (полярной и неполярной) поверхности с коэффициентом пропорциональности, равным 0,025 ккал/моль ∙ Å2.
Солевые мостики
В белках существует ограниченное число типов солевых мостиков. Солевые мостики встречаются во многих белках, например в гемоглобине [60] их образуют Lys-40 (а2-цепь)/а-карбоксил His-146 (β1-цепь); в парвальбумине [61] — Glu-81/Arg-75; в химотрипсине [18] и в трипсине [62] — а-аммонийная группа Ilе-16/Asp-194. Энергию электростатического притяжения рассчитать для них легко; она составляет около 5 ккал/моль для соседних карбоксильной и аммонийной групп (табл. 3.1) в среде с диэлектрической проницаемостью ε = 4.
Вклад свободной энергии солевого мостика незначителен. Чтобы оценить вклад солевых мостиков в стабильность белка в растворителе, следует сравнить их электростатическую энергию с энергиями притяжения обоих зарядов к молекулам растворителя, которые по нашей системе подсчета включены в параметр Нцепь. В растворителе заряд притягивает окружающие диполи (молекул Н2O) за счет электростатического монопольдипольного взаимодействия. Поскольку соответствующая энергия намного превосходит энергию электростатического притяжения между ионами, результирующая величина ∆Hцепь близка к нулю. Кроме того, стабильность зависит от свободной энергии [уравнение (3.1)], а не только от связывающей энергии, в связи с чем необходимо учитывать также изменение энтропии. Поскольку притягивающиеся диполи ориентированы вокруг заряда радиально, вокруг заряженной группы наблюдается более высокая упорядоченность воды — точно так же вокруг неполярной группы наблюдается более высокоупорядоченная квазикристаллическая структура воды. Вклад величины ∆Sраств, способствующей образованию солевого мостика, существен [15]. Результирующая общая свободная энергия ∆Gпepeнocблагоприятствующая образованию солевого мостика, составляет около 1 ккал/моль [60]. Удаление одного заряда из воды без образования солевого мостика полностью нарушает ∆Gпepeноc. Поэтому перенос отдельного заряда внутрь белка или в другие гидрофобные среды, например в мембраны, очень невыгоден при величине ∆Gпepeнocпорядка 10 ккал/моль.