Принципы структурной организации белков - Г. Шульц 1982
Ковалентная структура белков
Дисульфидные связи
Роль мостиков S-S во внеклеточных и внутриклеточных белках
Дисульфидные мостики определяют механические свойства внеклеточных белков. Дисульфидные мостики обычны в белках, которые переносятся или действуют во внеклеточном пространстве; типичными примерами служат змеиные яды и другие токсины, пептидные гормоны, пищеварительные ферменты, белки комплемента, иммуноглобулины, лизоцимы и белки молока. Кроме того, эти мостики играют важную роль в некоторых крупных структурах. Свойства вязкости и эластичности различных природных продуктов по крайней мере отчасти определяются дисульфидными мостиками между структурными белками [110]. Поперечные связи между молекулами кератина придают эластичность шерсти и волосу [110], когезионноэластичный характер теста из пшеничной муки определяется дисульфидами глютенина, а трехмерная сеть дисульфидов глютенина создает трудности при влажном помоле зерна. Таким образом, оказывается, что успехи в таких древних занятиях, как помол зерна, обработка шерсти и даже парикмахерское искусство, зависят от сложных конструкций дисульфидных связей [110].
Дисульфидные мостики определяют химические свойства внутриклеточных белков. Из тех белков, которые никогда не покидают своей клетки, лишь немногие содержат дисульфидные мостики. Во внутриклеточных белках дисульфиды, как правило, выполняют функции, не связанные со стабилизацией структуры. Так, в глутатионредуктазе дисульфид играет активную роль в катализе [111] (рис. 11.4); в треониндезаминазе дисульфиды (рис. 8.3) стабилизируют нужную конформацию ассоциированных белковых субъединиц [112]. Тиолдисульфидный обмен (рис. 4.3) может играть функциональную роль в регуляции ферментативной активности [113— 116]; обнаружено также, что обмен по этому механизму может происходить при взаимодействии связывающегося с мембраной сократительного белка и микротубулярного белка в процессе цикла деления яйца морского ежа [117]. Предположение, что реакции тиолсульфидного взаимодействия могут играть роль в специфических взаимодействиях между мембранными белками и внеклеточными белками, было отвергнуто в результате изучения двух известных систем: инсулин — мембранный рецептор [118, 119] и белки комплемента — мембранные рецепторы [120].
Своеобразная конструкция, основанная на образовании дисульфидных мостиков, обнаружена в ферментах триптофаназе [121] и треониндезаминазе [122] (рис. 8.3), выделенной из Salmonella. Здесь 4 идентичные полипептидные цепи попарно связаны дисульфидными мостиками, так что белки содержат по 2 (мономерные) субъединицы. Такая асимметричная агрегация, вероятно, связана с тем обстоятельством, что эти ферменты содержат по 2 центра связывания пиридоксальфосфата. Аналогичную функцию выполняют дисульфидные мостики между легкой и тяжелой цепями в иммуноглобулинах, где они обусловливают специфичность центра связывания.
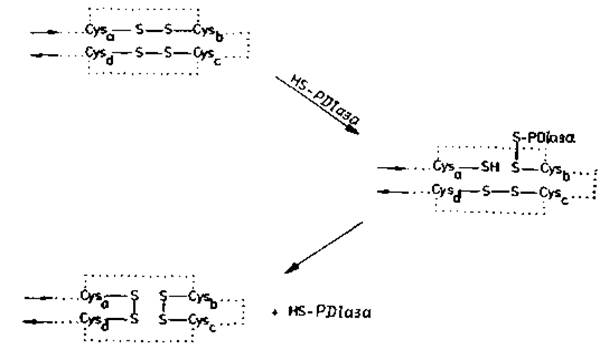
Рис. 4.3. Перегруппировка дисульфидных мостиков белка в результате реакций тиолдисульфидного обмена.
Cysa, Cysb и т. д. — дисульфидобразующие остатки полипептидиой цепи, ход которой намечен точками. Первым шагом перегруппировки дисульфида является катализ ферментом дисульфидизомеразой (РDІазой, ее каталитической тиольной HS-группой); при этой реакции образуется смешанный дисульфид белка и фермента [109]. Ряд последующих тиолдисульфидных взаимодействий приводит к новому набору дисульфидных мостиков в белке и к регенерации каталитической тиольной группы РDIазы. Дисульфидную изомеризацию белков может катализировать не только фермент дисульфидизомераза [104—106], но и другие S—Н-соединения, например восстановленный глютатион или дитиотрейтол (при рН>7).