Принципы структурной организации белков - Г. Шульц 1982
Ковалентная структура белков
Дисульфидные связи
Дисульфидные мостики как составные части структуры белков
Дисульфидные мостики, приводящие к образованию петель в полипептидной цепи, обнаружены в нескольких белках (пепсине, тиоредоксине, A-цепи инсулина, фиброине шелка [145], липоамидной дегидрогеназе и других пиридиннуклеотиддисульфидных оксиредуктазах [111]). Между мостиковыми цистеиновыми остатками в полипептидной цепи находится 2—4 остатка. Рассмотрение моделей, а также рентгеноструктурный анализ показывают, что такие петли имеют уплощенную жесткую структуру. В глутатионредуктазе и родственных ферментах в петле участвует изоаллоксазиновое кольцо FAD [123, 124].
Другой часто встречающийся структурный элемент — это последовательность — Cys—Cys—, когда оба остатка образуют дисульфидные мостики с другими цистеиновыми остатками [82]; геометрия пептидного звена не допускает образования дисульфидного мостика между соседними остатками. Таким образом, последовательность —Cys—Cys— создает возможность связывания и сближения трех сегментов цепи. Маловероятно, чтобы присутствие фрагментов —Cys—Cys—, соединенных S—S-связями, в 15 белках было случайным или что оно обусловлено общим происхождением этих белков. Поэтому было высказано предположение, что последовательность —Cys—Cys— представляет особенно полезную деталь белковой структуры и что многие белки в процессе эволюции независимо выработали эту последовательность (рис. 7.2).
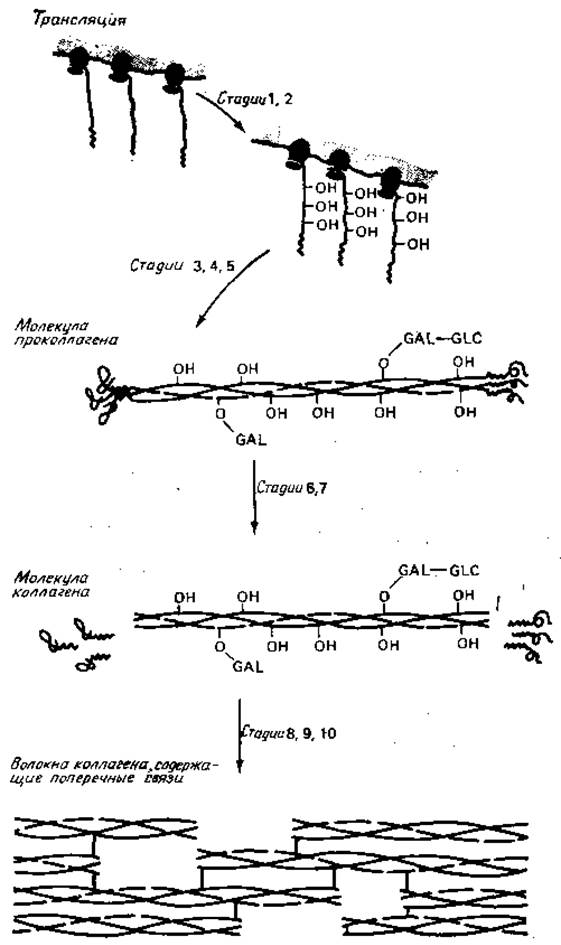
Рис. 4.4. Биогенез коллагена [131].
Идентифицированы следующие стадии: Стадия 1. Синтез пред-а1-цепей и пред-а2-цепей в отношении 2 : 1. Каждая цепь содержит 1300 остатков. Стадия 2. Гидроксилирование некоторых остатков Pro и Lys. Стадия 3. Присоединение сахаров (Glc—Gal) к гидроксилированным остаткам. Стадия 4. Образование тримера, связанное с образованием межцепных дисульфидных мостиков, которые, по-видимому, расположены на концевых участках цепей. Стадия 5. Образование тройной спирали в центре молекулы проколлагена. Стадия 6. Выделение проколлагена в межклеточное пространство. Стадия 7. Удаление глобулярных концевых фрагментов коллагена. Стадия 8. (Спонтанное) самоагрегирование молекул коллагена (образование волокон). Стадия 9. Дезаминирование Lys- и гидроксилированных остатков с образованием альдегидов. Стадия 10. Образование перекрестных связей между полипептидными цепями в волокне за счет реакций, использующих эти альдегиды, а также боковые цепи Lys и His (подробности см. в работах и [131]).