Принципы структурной организации белков - Г. Шульц 1982
Способы свертывания и ассоциации полипептидных цепей
Вторичная структура
Спираль коллагена
Структура коллагена представляет собой суперспираль, образованную тремя параллельными, вытянутыми левыми спиралями.
Спираль коллагена показана на рис. 5.6. Это правая спираль, состоящая из трех одиночных левых спиралей, расположенных параллельно. Такое образование называют суперспиралью. Рентгеноструктурный анализ коллагена представляет значительные трудности [191—194]: наиболее важная информация для расшифровки рентгенограммы коллагена может быть получена из сходных с ней картин рентгеновской дифракции синтетических полимеров — поли-Gly-II и поли-L-Pro-Il (поли-L-Pro-I содержит цис-пептидные связи). Особенно актуально построение моделей для Рrо-гомополимеров, поскольку у них двугранный угол ∅ фиксирован вблизи —60°, а образование структуры, подобной а-спирали (ψ = —60°), невозможно по стерическим причинам; приемлемыми оказываются лишь значения в области (∅ψ) = (—60°, + 140°) (рис. 2.3), хорошо описывающие строение отдельной спиральной нити коллагена.
* Поскольку полость не может быть заполнена водой, связывающая энергия понижена на pAV (р — давление, AV — свободный объем полости). Однако при атмосферном давлении это понижение составляет всего 0,001 ккал/моль для п-спирали из 50 остатков, т. е. пренебрежимо мало.
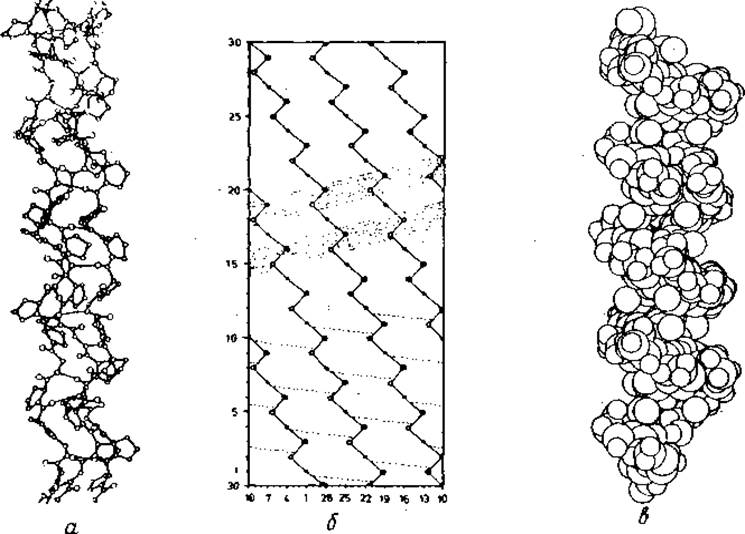
Рис. 5.6. Структура коллагена.
а — рисунок ORTEP [324] тройной спирали коллагена с последовательностью (Gly-Pro-Pr●)nи координатами из работы [193]. Приведены только те атомы водорода, которые участвуют в связях (тонкие, почти горизонтальные линии). б — цилиндрическая диаграмма полного периода идентичности тронной спирали коллагена [325]. Обозначены ход спирали и Са-атомы. Три Са-атома в последовательности (Gly-X-Y)n отмечены точками: (• О ●). Водородные связи указаны пунктиром, в — рисунок ORTEP тройной спирали коллагена, соответствующий а, но атомы заданы их вандерваальсовыми радиусами и включены все атомы водорода. Заметны спирально расположенные с шагом 9 Å выступающие остатки Pro. На рис. б они показаны затененными полосами.
Элементом группы суперспирали является триплет. Для детального анализа пространственного строения коллагена решающим оказалось знание аминокислотной последовательности [195—197]. Около 96% цепи может быть описано формулой (Gly-X-Y)m. Положение X часто занимает Pro, а положение Y — Нур (оксипролин = Pro с ОН-группой при Сm-атоме; см. рис. 1.1). Содержание- каждого из остатков Pro и Нур составляет 11%. До недавнего времени обсуждались три модели, построенные из тройных спиралей, образованных параллельными пептидными цепями [191, 192]. С наиболее часто встречающимся триплетом (Gly-Pro-Hyp) согласуется структура так называемого коллагена-ІI, все остальные модели в конце концов пришлось исключить [194].
Суперспираль лучше всего описывается с помощью цилиндрической развертки, показанной на рис. 5.6, б. Это линейная группа с триплетом (Gly -X-Y) в качестве элемента группы. В одном витке суперспирали на каждую полипептидную цепь приходится 10 триплетов; шаг суперспирали равен 86 Å. Три цепи стабилизированы вандерваальсовыми силами, а также водородными связями (по- одной на триплет). Диполи, образующие водородные связи, расположены линейно и приблизительно перпендикулярно к оси большой: спирали (рис. 5.6, б).
Отдельная полипептидная цепь левой спирали недостаточно упорядочена. Элементом группы левой спирали одиночной пептидной цепи следует считать триплет, поскольку он является элементом группы суперспирали. Идентичны не все, а только каждые третьи пары значений углов (∅, ψ). Однако отклонения в углах (∅, ψ) для всех остатков невелики и составляют около 10°. Поэтому структуру отдельной цепи можно аппроксимировать спиралью (линейной группой) с одним остатком в качестве элемента группы, которой отвечает одна конформационная точка на карте (∅, ψ) (рис. 2.3). Параметры спирали одиночной полипептидной цепи приведены в табл. 5.1. При значении спирального параметра d = 2,9 Å цепь настолько вытянута, что ее геометрия стабильна только при агрегации с другими цепями.
Остаток Gly в каждом третьем положении необходим для стабильности. Поскольку параметр n = —3,3 для левой спирали отдельной цепи нецелочислен и правая суперспираль содержит 10 триплетов на виток, то каждый третий Са-атом оказывается вблизи оси большой спирали. Этим объясняется необходимость именно- последовательности (Gly-X-Y)m, т. к. компактную, образованную за счет водородных связей структуру можно получить только при отсутствии боковых цепей у остатков вблизи оси; единственным таким остатком является Gly.
Боковые цепи остатков коллагена обращены в сторону окружающей среды. Внешний вид спирали коллагена создают боковые цепи остатков в положениях X и Y. Это особенно заметно на пространственной модели (Gly-Pro-Hyp)m. Как видно из рис. 5.6, в, боковые цепи Pro и Нур образуют расположенные на спиральной цилиндрической поверхности выступы с шагом 9 Å.
Коллаген — наиболее распространенный белок млекопитающих.
Коллаген, состоящий из сильно вытянутых полипептидных цепей, может выдерживать значительное механическое напряжение вдоль оси, поскольку оно по направлению совпадает с ориентацией ковалентных связей его пептидного остова. Поэтому структура коллагена хорошо соответствует характеру выполняемых им функций — передавать усилия в сухожилиях, образовывать защитный слой кожи и других органов. Коллаген безусловно является одним из самых распространенных в природе белков.
Тройные спирали коллагена большинства позвоночных состоят из двух а1-цепей и гомологичной а2-цепи. Пока известна аминокислотная последовательность только a1-цепи, которая включает 1052 остатка [195—197]. За исключением 16 N-концевых и 25 С-концевых остатков, состав (Gly-X-Y)m в ней строго соблюдается. Пользуясь этой формулой, можно легко выявить в различных аминокислотных последовательностях коллагеноподобные структуры. В глобулярных белках такие структуры пока еще не были обнаружены. Однако весьма вероятно, что они присутствуют в компоненте Clq системы комплемента человека [198], которая узнает антитела, соединенные с антигенами. Как установлено по электронным микрофотограммам, это белок содержит пучок из 18 параллельных цепей, организованных в шесть коллагеноподобных волокон, которые входят в шесть глобул. Возможно, что в дальнейшем будут выявлены и другие смешанные белки, содержащие коллагеноподобные структуры.