Принципы структурной организации белков - Г. Шульц 1982
Способы свертывания и ассоциации полипептидных цепей
Вторичная структура
Линейные группы
Вторичные структуры — это упорядоченные расположения основной цепи полипептида, безотносительно к типам боковых цепей и их конформациям. Все вторичные структуры стабилизированы водородными связями между пептидными амидными и карбонильными группами.
Основная цепь полипептида образует линейную структуру, если ее двугранные углы повторяются. Любая линейная группа представляет собой спираль. Если упорядоченность такова, что все последовательно расположенные пептидные звенья имеют идентичные взаимные ориентации, т. е. если все углы (∅, ψ) одинаковы (рис. 2.2), основная цепь полипептида образует линейную группу. Любая линейная группа есть спираль, которая может быть описана смещением вдоль винтовой оси d, приходящимся на элемент, числом n элементов на виток и расстоянием r от данной точки заданного элемента (здесь — Са-атома) до оси спирали (рис. 5.2). Поскольку величину d всегда считают положительной, хиральность спирали определяется знаком п. Каждая спираль имеет направленность, так как направлено образованное из N- и С-концов аминокислот пептидное звено.
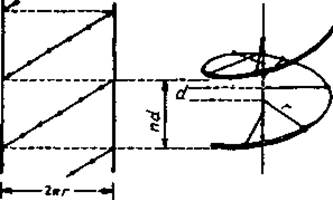
Рис. 5.2. Спираль, параметры спирали и развертка поверхности спирали. n — число остатков на виток, d — аксиальное смещение на остаток, nd — шаг спирали, r — радиус спирали. Для получения развертки поверхности спираль проецируют на коаксиально расположенный цилиндрический лист бумаги, этот лист разрезают параллельно оси спирали и затем разворачивают. Развертку поверхности называют также Цилиндрической диаграммой. Она делает наглядными геометрические соотношения между остатками. Изменение лицевой стороны обрезанного листа ведет к зеркальному изображению той же цилиндрической диаграммы.
На рис. 5.3 приведены кривые зависимости между углами (∅, ψ) (рис. 2.2) и параметрами спирали d и п. Спираль с |n|<2 невозможна. Имеется всего лишь несколько линейных групп, в которых нет стерических затруднений и которые стабилизированы водородными связями либо в пределах цепи (например, а-спирали), либо между соседними цепями (например, ß-складчатый лист, коллаген). Параметры наиболее важных линейных групп даны в табл. 5.1.
Линейные группы обнаружены также в сахарах, нуклеиновых кислотах и белковых агрегатах. Линейные группы были обнаружены в полисахаридах, элементом которых являются моно- или олигосахариды с боковыми цепями или без них [178], а также в РНК (ДНК), где рибозафосфатдиэфирные элементы обычно образуют в результате переплетения двух антипараллельных отдельных спиралей двойную спираль [179]. Вирус табачной мозаики состоит из белковой оболочки и РНК. Оболочка представляет собой линейную группу, элементом которой служит один белок, присоединенный к тринуклеотиду [180]. Цилиндрические конструкции из белков, найденные, например, в микротубулах [181], в хвостах фага Т4 [182] или в филаментах F-актина [183], часто описывают как спирали или линейные группы. Тем не менее следует помнить, что подобные агрегаты не содержат линейных цепей, таких, как, например, РНК, которая соединяет белковые субъединицы в вирусе табачной мозаики и образует особую спираль. Для описания таких моно- и полиспиральных образований используются различные способы.
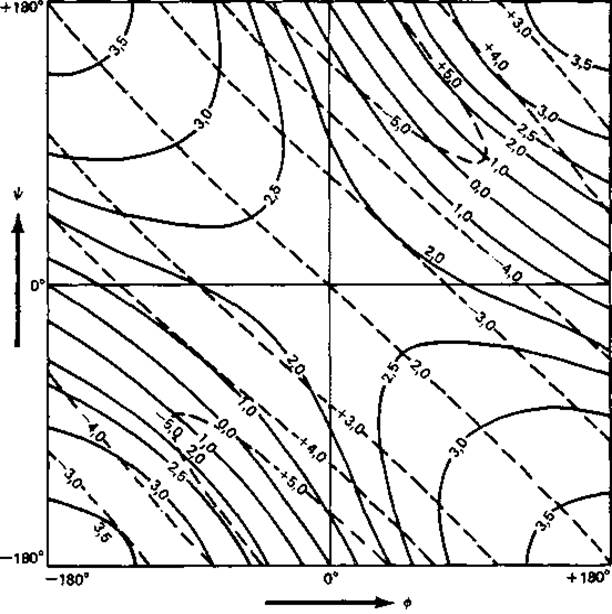
Рис. 5.3. Параметры спирали d (сплошные линии) и n (штриховые линии) как функции двугранных углов — и ψ [29].
У одной спирали значения — и ψ всех остатков одинаковы.
Таблица 5.1 Линейные группы, образуемые полипептидными цепями
|
Линейная группа |
Наблюдается |
Число остатков на виток n и хиральностьа |
Смещение на остаток d, Å |
Радиус спирали r, А |
|
Плоская параллельная ß-структура |
Редко |
±2,0 |
3,2 |
1,1 |
|
Плоская антипараллельная ß-структура |
» |
±2,0 |
3,4 |
0,9 |
|
Скрученная параллельная или антипараллельная ß-структура |
Часто |
—2,3 |
3,3 |
1,0 |
|
310-Спираль |
Небольшие участки |
+3,0 |
2,0 |
1,9 |
|
а-Спираль (правая) |
Часто |
+3,6 |
1,5 |
2,3 |
|
aL-Спираль (левая) |
Гипотетически |
—3,6 |
1,5 |
2,3 |
|
п-Спираль |
» |
+4,3 |
1,1 |
2,8 |
|
Спираль коллагена |
В волокнах |
-3,3 |
2,9 |
1,6 |
а Плюс и минус означают правую и левую спирали соответственно.
310-, а- и п-Спирали
Правильные спирали полностью описываются парой двугранных углов. Строение этих спиралей показано на рис. 5.4, а их параметры приведены в табл. 5.1. 310-, а- и п-Спирали стабилизированы водородными связями между пептидными амидной и карбонильной группами остатков (і, і -)- 3), (і, і + 4) и (і, і -)- 5) соответственно. Следовательно, имеется возможность образовывать спирали с системами последовательных водородных связей между близкоотстоящими элементами цепи. Являясь линейными группами, спирали полностью описываются одной точкой на карте —ψ (рис. 2.3). Эти точки отвечают локальным энергетическим минимумам; возможны небольшие отклонения от этих минимумов.
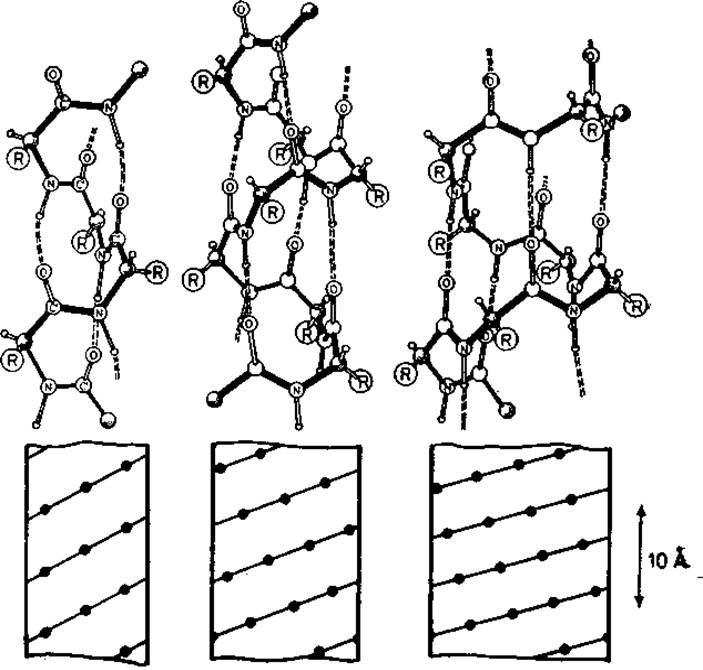
Рис. 5.4. Спирали полипептидных цепей с внутренними водородными связями.
Слева направо: 310-, а- и п-спираль. Внизу: цилиндрические диаграммы этих спиралей; показан ход цепей и положение Са-атомов.
а-Спираль очень стабильна и потому встречается наиболее часто. а-Спираль — наиболее часто встречающаяся в белках вторичная структура, в связи с чем ее конформация должна быть весьма стабильной. С этим согласуется расположение а-спирали в центре разрешенной области на карте —ψ (рис. 2.3), а также тот факт, что диполи ее водородных связей имеют линейное расположение, также отвечающее минимуму энергии (разд. 3.4). Кроме того, радиус спирали (табл. 5.1) благоприятствует дисперсионному притяжению между остатками, расположенными по разные стороны от оси спирали.
а-Спираль была впервые постулирована Полингом и сотр. [25]. В то время идея о спирали с нецелочисленным значением n была встречена скептически, поскольку она не согласовывалась с предположением о высокой степени упорядоченности молекул. Непосредственное подтверждение постулата было получено из данных рентгеноструктурного анализа кристаллического гемоглобина [183]. Позднее а-спирали были обнаружены во многих волокнах [184], в частности в а-кератине и парамиозине и почти во всех глобулярных белках. В самом деле, обозначения а и ß для а-спирали и ß-структуры появились в связи с тем, что все рентгенограммы волокон подразделяли на а- и ß-рентгенограммы, которые получали в основном от образцов а-кератина и ß-фиброина шелка.
На рис. 5.5 показано распределение наблюдаемых длин а-спиралей в глобулярных белках. Средняя длина составляет около 17 Å, что отвечает 11 остаткам на 3 витка спирали. Значительный разброс в распределении показывает, что предпочтительных длин не существует, что согласуется с ожидаемыми свойствами линейной группы. Относительные максимумы для длин из 7, 11 и 15 остатков, отвечающие 2, 3 и 4 полным виткам, меньше ожидаемой ошибки распределения Пуассона (≈ 251/2= 5), в связи с чем их значимость довольно сомнительна. а-Спирали обеспечивают белковые структуры довольно прочными «стержнями». Изгибы этих стержней на углы около 20° часто осуществляются путем включения остатков Pro, как это можно видеть в миоглобине [185] и аденилаткиназе [186].
310-Спирали встречаются редко и образуют только очень короткие участки. 310-Спираль получила название по числу остатков на виток n = 3 и по числу атомов (10) в цикле, образованном водородной связью [187]. Диполи, образующие водородные связи не находятся на одной линии, что не отвечает минимуму энергий (разд. 3.4). Упаковка боковых цепей в этом случае также довольно невыгодна. Как видно из рис. 5.4, боковые цепи имеют одинаковое азимутальное положение, тогда как в а-спирали они находятся в скрещенном положении. На карте (∅, ψ) (рис. 5.7) 310-спираль попадает на край разрешенной области, что свидетельствует о наличии небольших стерических трудностей. Энергетически невыгодное пространственное строение объясняет малую распространенность 310-спиралей в белках; обычно ее участки образуют примерно один виток (в гемоглобине морской миноги имеются две 310-спирали, каждая длиной по два витка [188, 189]). Эти участки обычно находятся при N- и С-концах а-спиралей.
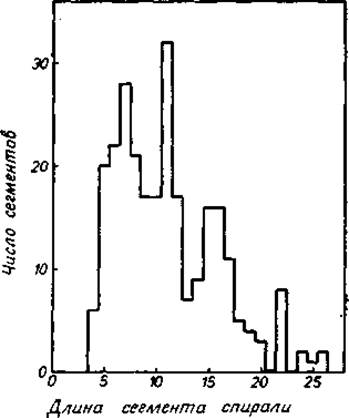
Рис. 5.5. Распределение длин а-спиральных сегментов для 23 белков (данные взяты из работы [323]).
Длины выражены в числе остатков.
п-Спираль невыгодна. п-Спираль ни разу не удалось наблюдать на опыте, так что она представляет пока чисто академический интерес. Эта спираль находится на краю разрешенной области (рис. 2.3), что указывает на наличие в ней стерических трудностей [29, 190]. Диполи, образующие водородные связи, выстроены благоприятно. Вследствие большого радиуса r (табл. 5.1), атомы основной цепи, находящиеся по разные стороны от оси спирали, уже не образуют стабилизирующих контактов друг с другом. Возникает аксиальная полость*, заметно понижающая энергию вандерваальсова притяжения. Как видно из цилиндрической функции на рис. 5.4, боковые цепи п-спирали расположены не так выгодно, как в а-спирали, но значительно благоприятнее, чем в 310-спирали. Отсутствие п-спиралей в реальных системах, по-видимому, следует объяснять стерическими трудностями, а также ослаблением вандерваальсова притяжения противостоящих элементов основной цепи.
Левые 310-, а- и п-спирали не были обнаружены. Если рассматривать только основную цепь полипептида, каждая спираль должна иметь энергетически эквивалентное зеркальное отображение. Однако взаимодействия боковых цепей приводят к энергетической невыгодностилевой аL-спирали, что и объясняет ее отсутствие в глобулярных белках. Это же относится и к левым 310- и п- спиралям.