Принципы структурной организации белков - Г. Шульц 1982
Модели, изображение и документация белковых структур
Представление полной структуры
Двумерные представления
Стереоизображения
Стереоизображения — информативные двумерные представления трехмерного объекта. Для публикации в периодической печати необходимы двумерные представления структуры. Для этой цели весьма удобны стереоизображения. Обычно такие стереоизображения состоят из двух расположенных рядом рисунков, центры которых разнесены на расстояние, равное расстоянию между зрачками (65 мм). Каждый из рисунков нужно рассматривать соответствующим образом; можно применять и специальное стереоустройство [400], Расстояние между рисунками (65 мм) налагает ограничение на размеры рисунков, так что они не превышают 50 х 50 мм. Очевидно, что при ограниченном разрешении печати не всегда можно вместить необходимый объем информации в такой формат. Можно несколько увеличить объем считываемой информации, печатая и рассматривая стереоизображения в красном и зеленом цветах. Однако взаимное исключение красного и зеленого цветов обычно неполно, к тому же цветная печать требует больших затрат, поэтому красно-зеленые стереорисунки применяются сравнительно редко.
Линейные изображения
Стереоскопическое линейное изображение хорошо описывает структуру. Чтобы представить свертывание цепи в журнальной статье, можно подготовить стереорисунки, в которых все Са-атомы связаны прямыми линиями (рис. 4.2, а). Иногда Са-атомы обозначаются маленькими кружками и порядковым номером. На таком стереорисунке исключительно хорошо прослеживается аминокислотная цепь, даже если она состоит из более чем 800 остатков, как в случае фосфорилазы [236].
Если нанести на рисунок не только Са-атомы и виртуальные связи между ними, но к все связи между неводородными атомами, стереоизображение всей молекулы окажется слишком громоздким и потеряет свою наглядность. Поэтому такие детали приводят только на специальных изображениях отдельных участков молекулы. Постоянно пополняющаяся коллекция стереопроекций различных частей всех известных полных структур белков приводится в атласе микрофишей AMSOM [401]. Несмотря на большую детализацию (около 103 изображений на молекулу), Атлас AMSOM дает только стандартные проекции. Более разносторонняя информация получается при изображении молекулы на дисплее катодно-лучевой трубки. Стереоскопического эффекта можно достичь путем разделения экрана на две половины или вращая рассматриваемую молекулу с определенной скоростью [397] (разд. 7.2).
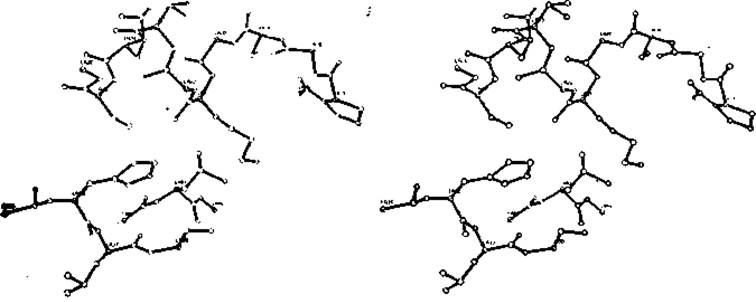
Рис. 7.5. Стереоизображение ORTEP [324] активного центра аденилаткиназы. Приведены только неводородные атомы; выделены атомы Са.
Графическую программу ORTEP можно использовать для построения как гибких, так и объемных моделей. Весьма изящное изображение молекулы может быть получено с использованием программы ORTEP, которую составил Джонсон [324] для изображения малых молекул. Программа ORTEP позволяет получить точное моно- или стереоизображения моделей из шариков и палочек. Она была использована для изображения структуры коллагена (рис. 5.6, а). Программа оказывается полезной при анализе функциональных элементов белковых молекул, например активного центра аденилаткиназы на рис. 7.5. Если задать каждый атом сферой с соответствующим вандерваальсовым радиусом, CRTEP дает прекрасное изображение поверхности молекулы в виде фотографии объемной модели (рис. 5.6, б). При этом, однако, возможны небольшие ошибки в местах пересечений сфер валентно связанных атомов.
Макеты структур
Макеты отображают лишь существенные части структуры. Поскольку объем графической информации по белку очень велик, читатель может потерять интерес, если эта информация будет представлена во всех деталях. Во многих случаях бывает вполне достаточно общего наброска, который выявляет лишь существенные части структуры. Этим объясняется довольно широкая распространенность так называемых структурных макетов (наиболее удачные
см. в [794]). На таких макетах а-спирали обычно изображают цилиндрами, а ß-складчатые листы — стрелками (рис. 7.6). Чтобы избежать грубых ошибок, эти макеты строятся обычно после того, как схема основной цепи выполнена компьютером.
В последнее время широкое распространение [235, 247, 255] получил своего рода молекулярный стриптиз, в результате которого все детали структуры сводятся к топологии ß-листов. При этом характер свертывания цепи определяется по направлению и соединениям ß-складчатых листов. Как показано на рис. 7.7, в результате получается по существу двумерное изображение. На более детальных схемах [235, 249] в местах соединения между складчатыми листами обозначены а-спирали (рис. 5.17, д). С помощью таких макетов удалось выявить ряд структурных особенностей, в частности преобладание правого ßξß-звена (разд. 5.2). Отметим, что топология ß-листа легко совмещается с данными об аминокислотной последовательности в виде простого графа [186].
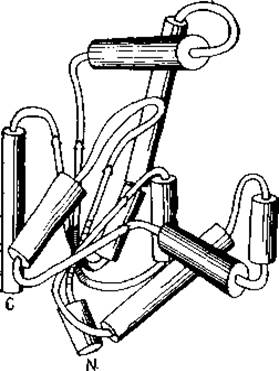
Рис. 7.6. Структурный макет аденилаткиназы. Спирали изображены в виде цилиндров, а ß-складчатые листы — в виде стрелок.
Структура водородных связей
Макеты можно эффективно использовать для представления стереохимических данных. Помимо общей информации, т. е. обозначений атомов и их координат, при описании полной структуры белка обычно приводят целый ряд важных дополнительных сведений, касающихся водородных связей и других видов невалентных взаимодействий между атомными группами скелета и боковыми цепями, а также данных о любом взаимодействии полипептидной цепи (включая ковалентное) с простетическими группами, кофакторами, субстратами, металлами и другими лигандами, молекулами воды и т. д. Обычно эти сведения объединены в длинный перечень, из которого по мере необходимости извлекается нужная информация. Значительно лучшей формой записи в некоторых случаях могут, однако, служить макеты структур, аналогичные показанному на рис. 7.8, которые предназначены для представления таких химических данных.
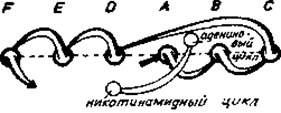
Рис. 7.7. Топология ß-структуры лактатдегидрогеназы и других чувствительных к NAD дегидрогеназ [255].
Скрученная параллельная ß-структура (рис. 5.10) не показана. Шесть цепей (круги A-F) обращены С-концами к наблюдателю. Все промежуточные участки, согласно определению (рис. 5.12, а), являются правыми.
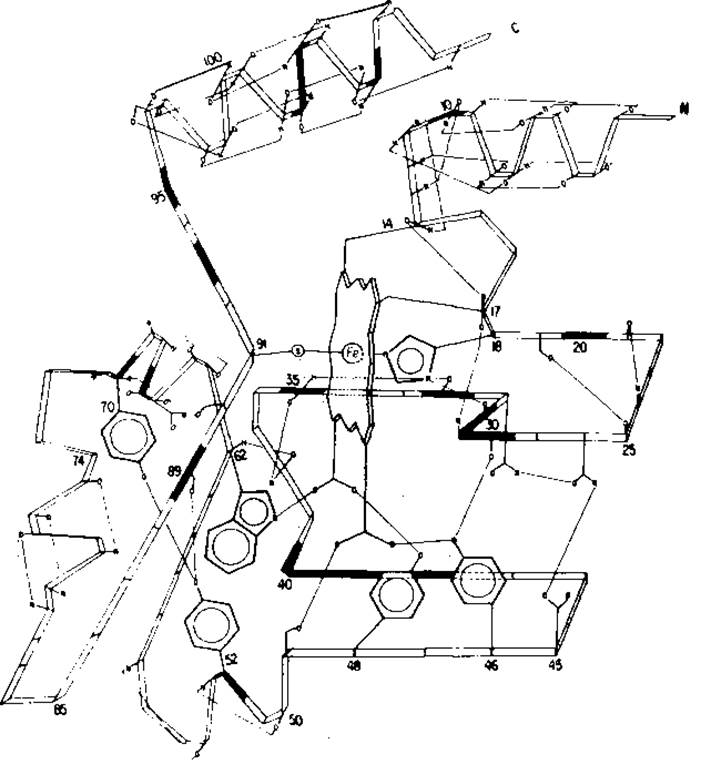
Рис. 7.8. Схематическое изображение цитохрома с2 из Rhodospirilliim rubrum [272] показывает систему водородных связей. Остатки на поверхности полости, в которой находится гем, зачернены. Схема нумерации не совпадает с использованной Дайхофом [145].