Принципы структурной организации белков - Г. Шульц 1982
Термодинамика и кинетика свертывания полипептидной цепи
Пути свертывания
Аналогично тому как шар скатывается с горы вниз до самой глубокой точки долины, так и полипептидная цепь свертывается в конформацию с наименьшей свободной энергией. В обоих случаях и шар, и полипептидная цепь следуют определенному пути и доходят до самой нижней, кинетически допустимой точки (локальный минимум), которая не обязательно отвечает абсолютно низшей точке (глобальный минимум). Вопрос заключается в том, проделывает ли шар (цепь) всегда один и тот же путь, после того как оставляет вершину горы (которую можно рассматривать как широкое плато, отвечающее большому числу конформаций несвернутой цепи), т. е. существует ли расщелина, направляющая шар на его пути вниз.
Дисульфидные связи — специфические индикаторы свертывания. Поиск такого пути представляет весьма трудную задачу, поскольку для этой цели необходимо охарактеризовать конформации цепи в растворе. Все спектроскопические методы дают при описании свертывания цепи лишь самые общие результаты (круговой дихроизм, например, позволяет оценить количество а-спиралей, усредненное по всем имеющимся конформациям). Наиболее точную, хотя и ограниченную, информацию о структуре можно получить, исследуя образование связей S—S, поскольку эти связи появляются только при соответствующей ориентации двух остатков Cys.
В настоящее время наиболее подходящим объектом для таких экспериментов является ингибитор трипсина поджелудочной железы быка (ВРТІ) [793]. ВРТІ — это небольшой белок известной структуры, содержащий 58 аминокислот в одной цепи и три дисульфидных мостика. Для изучения образования связи S—S и ее перегруппировки в процессе свертывания существенно, чтобы реакции с участием остатков Cys тщательно контролировались. Для этого используются низкомолекулярные тиолдисульфидные системы с известным окислительно-восстановительным потенциалом [451], например восстановленная и окисленная формы дитиотрейтола высокой чистоты. Очищенные реагенты, например иодоацетат, используют и для связывания свободных тиолов. При этом нет надобности в денатурирующих агентах, поскольку полностью восстановленный ВРТІ при физиологических условиях существует в развернутой форме.
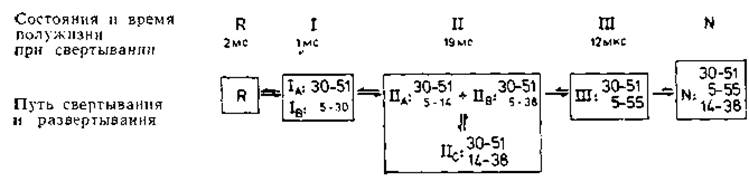
Рис. 8.1. Ковалентные промежуточные состояния на пути свертывания бычьего панкреатического трипсинового ингибитора (ВРТІ) (451, 793]. Обозначения пояснены в тексте. «Правильные» дисульфидные связи показаны в крайней рамке справа. В промежуточных состояниях, например ІІА и ІІВ, «правильные» дисульфидные связи изображены тем же шрифтом, что и в N-состоянии. Приведенный на рисунке путь свертывания относится к быстро свертывающимся цепям, т. е. к 85% несвернутых молекул.
Добавление дисульфида (например, окисленного дитиотрейтола) к раствору восстановленного ВРТІ означает начало свертывания. В этом процессе отчетливо выделяют три промежуточные стадии (I, II и III [451]), которые показаны на рис. 8.1. Переходы от одной стадии к следующей характеризуются существенно различными временными постоянными, что указывает на различия активационных барьеров. На стадии I имеются два преобладающих вещества ІА и ІВ соответственно с правильным и неправильным дисульфидными мостиками. Поскольку образование связи S—S и ее разрыв происходят в течение микросекунд, относительные частоты этих однодисульфидных молекул отражают их относительные термодинамические стабильности. Конформация ІВ далее не развивается; только конформация ІА переходит на следующую стадию, на которой образуются три преобладающие формы с двумя мостиками в каждой: ІІА, ІІВ и ІІС. Все они сохраняют первый правильный мостик, в ІІА и ІІВ добавляется неправильный мостик, а в ІІС — правильный. Интересно, что форма ІІС не получает развития, хотя она и содержит два правильных мостика. Только формы ІІА и ІІВ переходят на стадию III, на которой имеется одна форма, содержащая первоначальный правильный мостик и еще один дополнительный правильный мостик. Это превращение происходит очень медленно, поскольку для него необходимо конформационное изменение с высокой энергией активации. Переход от стадии III к нативному белку, напротив, происходит очень быстро.
Для свертывания необходимы промежуточные состояния, не входящие в нативную конформацию. Наиболее неожиданный результат заключается в том, что свертывание не есть последовательное все большее и большее приближение к нативной структуре, но что для него необходимы состояния ІІА и ІІВ, которые не входят в окончательную нативную структуру. Этот аспект еще более отчетливо проявляется в случае рибонуклеазы, повторное свертывание которой также было прослежено аналогичным образом [458]. Как и BPTI, этот белок можно ренатурировать только путем образования дисульфидных мостиков. Но в отличие от BPTI на ранней стадии свертывания рибонуклеазы требуются по крайней мере три мостика, причем они могут быть случайными, что опять подтверждает необходимость ненативных интермедиатов. Отсюда следует вывод, что укладка белка начинается с образования нуклеаций на локальных участках цепи и что, прежде чем продолжится дальнейшее свертывание [459], необходимый вклад в свободную энергию (—ΔSцепь) должны внести дисульфидные мостики. Процесс свертывания in. vitro происходит очень медленно и продолжается около 20 мин.
В случае лизоцима первые две нативные дисульфидные связи образуются на порядок быстрее, чем две последующие, что указывает на наличие предпочтительного пути свертывания [460]. Однако, этот путь не обязательно единственный, что и было показано другими исследованиями лизоцима [162]. В этих экспериментах удалось ренатурировать восемь возможных изомеров (восстановленного лизоцима), содержащих по одному постоянно блокированному остатку Cys на молекулу белка. Все изомеры представляли собой ферментативно активные структуры. Этот факт исключает уникальную роль в процессе свертывания какой-либо из возможных дисульфидных связей. Следует особенно подчеркнуть, что ни одна из четырех нативных дисульфидных связей не обязательна для образования трех других правильных связей S—S.
Свертывание кооперативно. Как и переходы спираль — клубок (см. приложение), свертывание и развертывание белковой цепи — кооперативный процесс. Конкретизируем это общее положение для BPTI. Все промежуточные формы в этом случае нестабильны; положение конформационного равновесия смещается от развернутого, восстановленного белка до нативного состояния с тремя связями: S—S. Как видно из рис. 8.2, молекулярная заселенность существенна только для этих двух состояний и ВРТІ можно в хорошем приближении представить системой из двух состояний.
Свертывание может существенно отличаться у белков с дисульфидными связями и без них. Свертывание цистинсодержащих белков происходит на один-два порядка медленнее, чем свертывание белков той же величины без дисульфидных связей (разд. 8.2). Поскольку само образование дисульфидной связи не является стадией, определяющей скорость процесса, то эти белки по характеру свертывания, по-видимому, принадлежат к различным классам. По этой причине исследование механизма укладки цепи дисульфидсодержащего белка может иметь ограниченное значение для свертывания белков без таких мостиков.
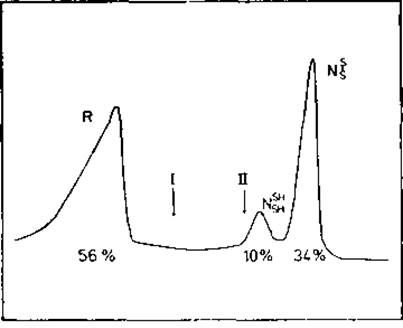
Рис. 8.2. Модель свертывания белка с двумя состояниями [451].
Бычий панкреатический трипсиновый ингибитор (ВРТІ) был выдержан в растворе, содержащем 1 мМ восстановленного и 30 мМ окисленного дитиотрейтола. Образующаяся при этих условиях полностью восстановленная форма ВРТІ развернута. После установлення равновесия перехода свертывание — развертывание белок извлекали с помощью иодоацетата разделяли гель-электрофорезом и количественно охарактеризовывали. Согласно электрофоретическим данным в равновесии находятся только несвернутое состояние R и нативные состояния NSHSH (=III; рис. 8.1) и NSS (=N; рис. 8.1). Интермедиаты I и II процесса свертывания отсутствуют.
Медленное и затрудненное развертывание и повторное свертывание белков, содержащих связь S—S, можно объяснить с точки зрения физиологии. Такие белки обычно являются внеклеточными, где они должны быть стабильными при различных меняющихся воздействиях окружающей среды. Кинетическая стабильность позволяет им сохранять квазинативное состояние в условиях денатурации до тех пор, пока временные константы воздействия среды остаются меньше, чем константы процессов развертывания. Время «полуразвертывания» ВРТІ (стадия III —II, рис. 8.1) составляет несколько часов [451].
В некоторых случаях медленное свертывание и медленное развертывание цепи могут определять продолжительность жизни белка. После завершения свертывания в клетке такой белок должен выделяться во внеклеточное пространство. Как только он развертывается, он становится подверженным действию протеаз, поскольку повторное свертывание происходит через образование подвижных промежуточных форм с относительно большими временами «полужизни».
Обычно в дисульфидсодержащих белках часть связей S — S необходима для термодинамической стабильности. Рассмотрим еще раз вопрос о том, насколько необходимы дисульфидные связи для стабильности нативной структуры. Набор поперечных сшивок, уникальный и характеристичный для упорядоченного состояния цепи, стабилизирует это состояние в связи с понижением энтропии несвернутой формы цепи с тем же набором поперечных связей. Для белка из 120 остатков вклад четырех связей S—S в стабильность нативной конформации составляет приблизительно 4x2 = 8 ккал/моль (уравнение (8.2)). Из данных о том, что большинство внеэпителиальных белков имеет величину ∆Goбщ около 10 ккал [413] и что они денатурируются, если все дисульфиды восстановлены (табл. 4.1), следует, что для термодинамической стабильности этих белков необходим энергетический вклад одной или большего числа дисульфидных связей; конкретное число таких связей варьируется в зависимости от белка (табл. 4.1).