Принципы структурной организации белков - Г. Шульц 1982
Термодинамика и кинетика свертывания полипептидной цепи
Влияние лигандов
Как правило, лиганды стабилизируют нативную структуру.
Для некоторых белков образование нативной конформации зависит от присутствия специфических лигандов, часто ионов металлов или других простетических групп [94, 413]. Наличие лиганда не обязательно приводит к существенно иной конформации свернутого белка, но способствует стабилизации его нативной формы. На основании опытов по водородному обмену [415], а также с помощью кривых денатурации мочевиной [461] апомиоглобина, глобулярного белка с ∆Goбщ ≈ 9 ккал/моль, установлено, что этот белок должен быть на 4 ккал/моль менее стабилен, чем миоглобин. Противоположным примером является цитохром с, присутствие в котором ковалентно связанной группы гема абсолютно необходимо для стабильности белковой структуры. При удалении этой группы белок перестает быть глобулярным [462]. Если удалить только ион железа, белок остается глобулярным, хотя и менее стабильным, например, к термической денатурации [463].
Более подробно влияние лигандов тимидин-3,5-дифосфата (TDP) и Са2+ было изучено для нуклеазы Т, протеолитического производного нуклеазы стафилококка [94]. Константу равновесия системы нативная конформация — развернутая конформация можно выразить как К = k+1/k-1, где k+1 — константа скорости свертывания, a k-1 — константа скорости развертывания. Присутствие лигандов не влияет на скорость свертывания нуклеазы Т [461], однако скорость развертывания в присутствии Са2+ и TDP уменьшается в 20 раз.
Для всех белков, содержащих функционально важные лиганды, пока еще не разрешены два существенных вопроса: на какой стадии процесса свертывания начинает принимать участие лиганд и каким образом полипептидная цепь в условиях in vivo отбирает свою специфическую простетическую группу, например данный металл при наличии многих альтернатив.
Свертывание пируваткиназы обеспечивается L-валином. Влияние аминокислоты L-валина на ренатурацию пируваткиназы [466] дрожжей и треониндезаминазы Е. coli [468] иллюстрирует две различные функции, которые могут выполнять лиганды в процессе образования активных олигомерных белков. Пируваткиназа [467] — это тетрамерный фермент, построенный из четырех идентичных субъединиц, каждая из которых содержит одну молекулу невалентно связанного L-валина. Субъединицы диссоциируют и развертываются при действии 6 М гидрохлорида гуанидина. При выдерживании в ренатурирующей среде L-валин служит специфичным инициатором процесса повторного свертывания. Он индуцирует ренатурацию с константой скорости псевдопервого порядка по отношению к мономеру, а это означает, что L-валин влияет на свертывание мономерной формы в ее нативную конформацию и что завершающим процессом является спонтанное образование тетрамерного фермента. L-Валин остается составной частью всей структуры молекулы нативного белка [466].
Лиганды индуцируют формирование ферментов. В отличие от рассмотренного выше случая для треониндеаминазы, димерного фермента с молекулярной массой 360 000, содержащего две пиридоксальфосфатные группы (рис. 8.3), L-валин (или L-изолейцин) служит только в качестве катализатора и не присоединяется к молекуле фермента [468]. Неактивный олигомер при этом проходит дополнительное формирование, в результате которого получается ферментативно активный препарат. При pH 7,5 и выше для этого процесса, являющегося непременным условием активации [469]. L-валин совершенно необходим.
Существуют и другие примеры олигомерных ферментов, образование которых обязательно проходит через каталитически неактивные промежуточные формы. Эти формы претерпевают конформационное превращение на более поздней стадии, давая термодинамически стабильный активный фермент. Такой процесс конформационного «дозревания» имеет лимитирующую скорость и представляет собой практически необратимую стадию в образовании фермента. Предполагают [472], что в некоторых олигомерных ферментах аллостерические лиганды могут специфически ускорять формирование. Подобное воздействие аллостерических лигандов отличается от их влияния на активность фермента, когда они стабилизируют или активную, или неактивную конформацию белка при условии легко обратимого равновесия.
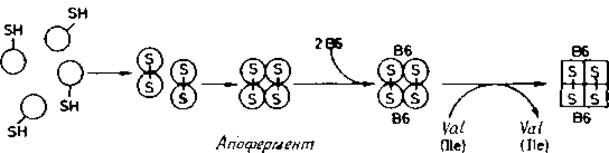
Рис. 8.3. Образование активной треониндезаминазы из свернутых мономеров [122], Кругами обозначены четыре мономера, каждый из которых включает SH-гpyппy, использующуюся для образования дисульфида с идентичной SH-группой другого мономера. Две пары объединенных субъединиц образуют апофермент; присоединение кофактора пиридоксальфосфата (витамин B6) приводит к неактивному холобелку, который переходит при каталитическом воздействии Val (или Ilе) в активный фермент [468]. Последняя стадия названа в [472] «прекондиционированием».