Принципы структурной организации белков - Г. Шульц 1982
Термодинамика и кинетика свертывания полипептидной цепи
Моделирование процесса свертывания
Чтобы определить трехмерную структуру по аминокислотной последовательности, необходимо понять механизм укладки цепи.
Трехмерная структура белка определяется невалентными взаимодействиями между аминокислотными остатками цепи, а также между этими остатками и растворителем (гл. 3). В принципе, если учесть все эти взаимодействия, можно рассчитать нативную конформацию по известной ковалентной структуре. Однако поскольку нативная конформация может не отвечать глобальному энергетическому минимуму, то расчет энергии всех возможных конформаций цепи может не привести к правильному ответу. Наиболее существенно, однако, что для рассмотрения всех возможных конформаций цепи потребуется машинное время, намного превышающее возраст Земли. Очевидно поэтому такие расчеты можно осуществить лишь в том случае, если не делать попытки охватить все статические структуры, а попытаться смоделировать процесс свертывания, следуя природному пути свертывания данной цепи. Если этот путь однозначен (аналогия с глубокой расселиной и шаром; разд. 8.2), то расчеты умеренной точности смогут привести к правильному решению задачи. Но если путь определен недостаточно хорошо, требуется высокая точность расчетов.
Моделирование свертывания основано на иерархии уровней структуры белка. Было предпринято несколько попыток промоделировать процесс свертывания, например, апомиоглобина (470], ВРТІ [30, 404] и парвальбумина [471]. Все они основаны на предположении о строгой иерархии уровней белковой структуры (разд. 5.6) при допущении, что а-спирали нативной структуры уже сформированы в еще не полностью свернутой цепи. Такое предположение отчасти подтверждается данными иммунологических исследований, по которым можно судить о содержании а-спиралей в несвернутой цепи [418, 454], а также достаточно удовлетворительными результатами методов предсказания а-спирали (разд. 6.5). Моделирование свертывания цепи выполняется а posteriori для белков, структуры которых определены с помощью рентгеноструктурного анализа. Применение такого моделирования к белку с неизвестной трехмерной структурой потребует информации об а-спиральных участках цепи; отчасти эта информация может быть получена с помощью методов предсказания (гл. 6).
Свертывание апомиоглобина рассматривалось как сборка а-спиралей. Моделирование свертывания апомиоглобина [470J было выполнено без применения ЭВМ, поскольку использовалась предельно простая модель, в которой были заранее заданы девять спиралей, наблюдающихся в нативной структуре (рис. 8.4, а). Это существенно сузило рассматриваемое конформационное пространство. На начальной стадии процесса свертывания были определены четыре структурные нуклеации, каждая из которых содержала три соседние по цепи а-спирали. В каждой нуклеации спирали располагались различным образом. Свободная энергия этих спиральных образований рассчитывалась исключительно по гидрофобным взаимодействиям (разд. 3.5) крупных неполярных боковых цепей; предполагалось, что ни одна из заряженных боковых цепей не находится внутри белка. Из большого числа полученных спиральных конструкций последующему анализу подвергнуты только 40 наиболее предпочтительных по энергии структур, попадающих в интервал 4 ккал/моль, считая от уровня, соответствовавшего форме с самой низкой свободной энергией. На последующих стадиях моделирования к этим нуклеациям присоединяли другие спирали и комбинировали структуры до тех пор, пока вся цепь не оказалась свернутой. Начиная с некоторой стадии, учитывали только такие конформации, свободная энергия которых превышала минимальную не более чем на 4 ккал/моль. Эта процедура привела к 19 различным способам свертывания цепи. Как и ожидалось, расположение спиралей с минимальной свободной энергией (рис. 8.4, б) отвечало нативной структуре миоглобина (рис. 8.4, в). Однако различия вычисленных энергий для этой формы и структуры со следующей по величине свободной энергией составили всего 3%, что намного меньше ожидаемой ошибки.
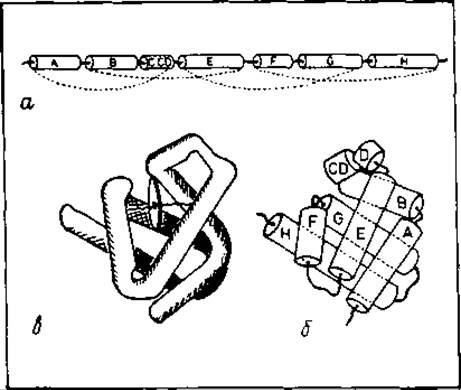
Рис. 8.4. Моделирование свертывания апомиоглобина [470]. а — а-спирали, наперед заданные в начале моделирования процесса свертывания. На начальной стадии учитывались четыре отмеченные на рисунке нуклеации, каждая из которых включает три а-спирали. б — результат моделирования свертывания цепи, отвечающий минимальному рассчитанному значению ∆Gобщ. в — модель молекулы миоглобина по данным рентгеноструктурного анализа.
Рассматривая этот метод, необходимо сделать следующие замечания: а) метод применим только к белкам класса I (табл. 5.2), т. е. к белкам, состоящим преимущественно из а-спиралей; б) на начальной стадии расчета допускается существование крупных нуклеаций, составляющих одну треть молекулы, хотя экспериментальные данные о таких нуклеациях пока отсутствуют; в) предполагалось, что в такие нуклеации входят соседние по цепи спирали, что отвечает низкой энтропии цепи и наличию сильной корреляции по соседним остаткам (разд. 8.3); г) считалось, что нативная структура свертывается прямым путем: все промежуточные структуры отбрасывались как неспособные к перегруппировке. Последнее предположение находится в противоречии с опытами по белкам, содержащим дисульфидные связи, которые выявили существование промежуточных форм с геометрией, существенно отличающейся от нативной (рис. 8.1). Однако процесс свертывания апомиоглобина происходит намного быстрее, и поэтому можно предположить его большую направленность по сравнению со свертыванием дисульфидсодержащих белков (разд. 8.2).
В ВРТІ и парвальбумине свертывание упрощенной цепи производилось путем спуска по градиенту энергии. Несколько иной метод был использован для моделирования свертывания цепи ВРТІ [30, 404] и парвальбумина [471]. В этом случае полипептидная цепь рассматривалась более детально, чем при моделировании апомиоглобина, однако аппроксимация оставалась грубой, поскольку в качестве независимой переменной использовался только угол вращения вокруг виртуальной связи Са—Са (рис. 7.10). Виртуальный валентный угол при Са-атоме считался функцией торсионного Са-угла; боковые цепи были заданы жесткими сферами (рис. 7.10).
Это упрощение снизило число независимых параметров до 1 на остаток.
Моделирование процесса свертывания было начато с цепи, имеющей вытянутую квазибеспорядочную конформацию; исключение было сделано для нативных а-спиралей, которые считались уже сформированными. Затем выполнялся спуск по градиенту свободной энергии. Кинетическая энергия цепи в этом процессе не принималась во внимание. Для учета температурных флуктуаций (разд. 8.1) необходимо «встряхивать» цепь через короткие интервалы времени. Поскольку это заняло бы слишком много машинного времени, «возбуждение» цепи проводили, только если она попадала в минимум энергии, с тем чтобы вывести ее из возможного локального минимума. В отличие от расчетов апомиоглобина в этом методе рассматриваются как гидрофобные силы, так и связывающая энергия. Кроме того, не производилось фиксации каких-либо субансамблей и допускались непрерывные перегруппировки во всех частях цепи. В результате было показано, что с вероятностью 50% цепь ВРТІ свертывается в нативную конформацию со среднеквадратичным отклонением Са-атома около 6 А. Однако даже самые лучшие результаты привели к неправильной топологии ß-структуры, за что и были подвергнуты критике [801]. Следует отметить, что это моделирование не учитывало специфического образования дисульфидных связей, происходящего в процессе свертывания ВРТІ (рис. 8.1). Использование этой информации может оказаться полезным в дальнейших исследованиях. Однако экспериментальные данные по ренатурации дисульфидсодержащих белков показывают, что путь свертывания таких белков может быть значительно сложнее свертывания других белков (см. с. 189), в связи с чем дисульфидсодержащие белки являются, по-видимому, не самыми удачными объектами для развития теоретического анализа.
В случае парвальбумина [471], а-спирального белка класса I (табл. 5.2), моделирование свертывания оказалось менее успешным. Отчасти это можно объяснить тем, что не была учтена возможность связывания в двух местах иона Са2+. Поскольку эти центры расположены в коротких петлях между спиралями [59], можно предполагать, что они влияют на относительную ориентацию соседних спиралей, а значит, и на процесс свертывания.