БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 2. ОСНОВНЫЕ ПРЕДСТАВЛЕНИЯ О СТРУКТУРЕ И ФУНКЦИИ БЕЛКОВ
2.10. Полипептидная цепь может поворачиваться на 180° благодаря образованию β-изгибов
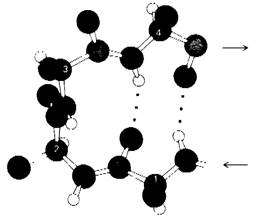
Большинство белков имеют компактную шарообразную (глобулярную) форму, обусловленную тем, что их полипептидные цепи делают много изгибов, меняющих направление цепи на 180°. Исследования трехмерной структуры многочисленных белков показали, что во многих случаях поворот цепи в противоположном направлении осуществляется благодаря наличию одного и того же структурного элемента, называемого β-изгибом. Этот изгиб, имеющий вид шпильки для волос, образуется в результате того, что СО-группа остатка n в полипептидной цепи присоединяется водородными связями к NН-группе остатка (n + 3) (рис. 2.42). В результате направление полипептидной цепи меняется на противоположное.
Рис. 2.42. Структура β-изгиба. СО-группа остатка 1 изображенного здесь тетрапептида присоединяется водородными связями к NН-группе остатка 4; в результате образуется такой же изгиб, как в шпильке
2.11. Структурные уровни в архитектуре белков
Принято различать четыре структурных уровня в архитектуре белковой молекулы. Первичная структура-это просто последовательность аминокислот в белке и локализация дисульфидных мостиков, если таковые имеются. Таким образом, первичная структура представляет собой полное описание ковалентных связей в белке. Вторичная структура образуется в результате стерического взаимодействия аминокислотных остатков, расположенных вблизи друг друга в линейной последовательности. Некоторые из этих стерических взаимодействий носят регулярный характер, обусловливая тем самым периодичность структуры. Примерами вторичной структуры могут служить а- спираль, складчатый Р-слой и коллагеновая спираль. Третичная структура обусловлена стерическим взаимодействием аминокислотных остатков, далеко отстоящих друг от друга в линейной последовательности. Следует отметить, что различие между вторичной и третичной структурами довольно условно. Белки, содержащие несколько полипептидных цепей, обладают еще одним уровнем структурной организации, а именно четвертичной структурой. Под четвертичной структурой подразумевают способ укладки цепей относительно друг друга. Каждая полипептидная цепь в таком белке носит название субъединицы. Часто используют также термин домен, которым обозначают компактную глобулярную единицу белковой структуры. Многие белки состоят из нескольких доменов с массой от 10 до 20 кДа. В белках большой молекулярной массы отдельные домены соединяются между собой относительно гибкими участками полипептидной цепи.
2.12. Последовательность аминокислот определяет трехмерную структуру
Взаимосвязь между последовательностью аминокислот в белке и его конформацией была обнаружена Кристианом Анфинсеном (С. Anfinsen) при изучении рибонуклеазы - фермента, расщепляющего РНК. Рибонуклеаза образована одной полипептидной цепью, состоящей из 124 аминокислотных остатков (рис. 2.43).
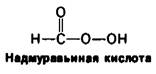
Она содержит четыре дисульфидных мостика, которые можно необратимо окислить надмуравъиной кислотой с образованием остатков цистеиновой кислоты (см. рис. 2.32). Можно также вызвать обратимое расщепление этих дисульфидных связей путем восстановления их таким реактивом, как β-меркаптоэтанол; при этом образуются смешанные дисульфиды
НО—СН2 —СН2—SН
β-меркаптозтанол
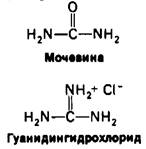
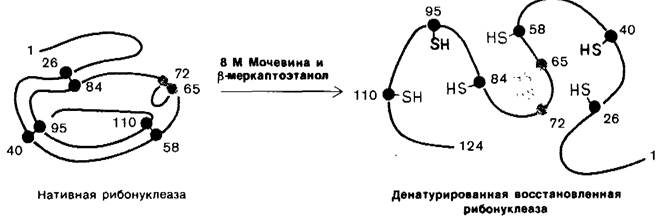
β-меркаптоэтанола с боковыми цепями цистеина (рис. 2.44). В присутствии большого избытка β-меркаитоэтанола смешанные дисульфиды тоже восстанавливаются, и в результате образуется белок, в котором все дисульфидные группы (остатки цистина) полностью превращены в сульфгидрильные (остатки цистеина). Оказалось, однако, что при 37°С и pH 7 реакция восстановления рибонуклеазы β-меркаптоэтанолом протекает лишь в том случае, если предварительно нарушают компактную структуру белка, частично развертывая его путем обработки денатурирующими агентами (мочевиной или гуанидингидрохлоридом). Хотя механизм действия этих денатурирующих агентов до конца не выяснен, все же очевидно, что они разрывают нековалентные связи. Полипептидные цепи, лишенные этих связей, в 8 М растворе мочевины или в 6 М растворе гуанидингидрохлорида свертываются случайным образом, т.е. образуют случайный клубок, о чем судят по таким физическим параметрам, как вязкость и спектры оптического вращения. Если рибонуклеазу обработать Р-меркаптоэтанолом в 8 М растворе мочевины, то продуктом реакции будет полностью восстановленная, случайным образом свернутая полинеитидная цепь, лишенная ферментативной активности. Другими словами, эта обработка вызывает денатурацию рибонуклеазы (рис. 2.45).
Рис. 2.43. Последовательность аминокислот в рибонуклеазе крупного рогатого скота. Цветом выделены четыре дисульфидные связи
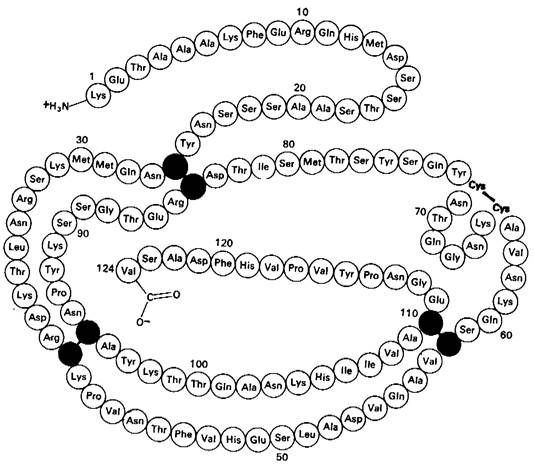
Рис. 2.44. Восстановление дисульфидных связей в белках избытком сульфгидрильного соединения типа β-меркаптоэтанола
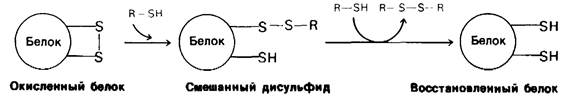
Рис. 2.45. Восстановление и денатурация рибонуклеазы
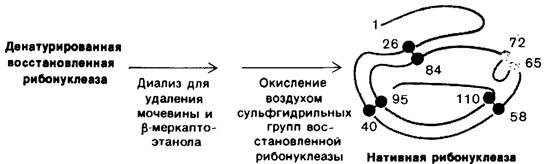
Анфинсен сделал очень важное наблюдение: если денатурированную рибонуклеазу очистить путем диализа от мочевины и β- меркаптоэтанола, то ферментативная активность белка постепенно восстанавливается. Анфинсен понял, как велико значение этого случайного наблюдения, и тут же дал ему объяснение: сульфгидрильные группы денатурированного фермента окисляются воздухом, и фермент вновь спонтанно принимает каталитически активную форму. Дальнейшие детальные исследования показали, что путем окисления в соответствующих условиях всех сульфгидрильных групп можно практически полностью восстановить исходную ферментативную активность (рис. 2.46). Все исследованные физические и химические свойства такого ренатурированного фермента были практически идентичны свойствам нативного фермента. Эти опыты показали, что вся информация, определяющая специфическую пространственную структуру рибонуклеазы, заключена в последовательности аминокислот. Последующие работы на других белках выявили универсальность этого центрального в молекулярной биологии принципа: последовательность определяет конформацию.
Рис. 2.46. Ренатурация рибонуклеазы
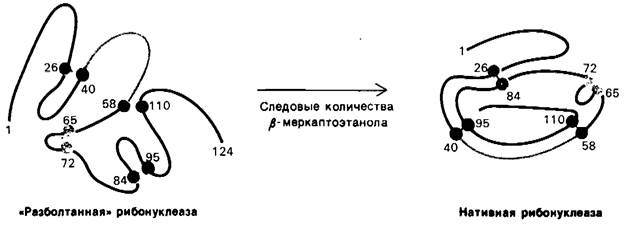
Совершенно другие результаты получаются, если восстановленную (денатурированную) рибонуклеазу подвергнуть окислению в 8 М растворе мочевины и лишь после этого удалить мочевину путем диализа. Ферментативная активность такого препарата рибонуклеазы составляет только 1% активности нативного белка. Почему при окислении денатурированной рибонуклеазы в отсутствие мочевины ферментативная активность восстанавливается, а в присутствии мочевины-практически нет? Ответ заключается в следующем: когда окислению подвергается случайным образом свернутая молекула восстановленного белка, образуются ошибочные дисульфидные пары, т.е. связанными дисульфидными мостиками оказываются пары аминокислот, иные, чем в нативном белке. Возможны 105 различных способов связывания восьми цистеинов с образованием 4 дисульфидов; только одна из этих комбинаций обладает ферментативной активностью. Остальные 104 комбинации были образно названы «разболтанной» (scrambled) рибонуклеазой. Впоследствии Анфинсен обнаружил, что «разболтанная» рибонуклеаза спонтанно превращается в полностью активную, нативную, форму, если в раствор вновь окисляемого ферментного белка добавить следовые количества β-меркаптоэтанола (рис. 2.47). Добавленный β-меркаптоэтанол катализирует перераспределение дисульфидных мостиков, которое в конечном итоге приводит к формированию нативной структуры, что занимает примерно 10 ч. Весь процесс целиком идет за счет снижения свободной энергии системы по мере того, как «разболтанные» конформации превращаются в стабильную нативную конформацию фермента. Таким образом, нативная форма рибонуклеазы является, по-видимому, термодинамически наиболее стабильной структурой.
Анфинсен (1964) писал: «Меня поразило, что на самом деле последовательность аминокислот в молекуле белка, который должен принять точно определенную геометрическую форму, следует рассматривать как мелодию, написанную в канонической форме; по предписанию Природы эта мелодия, накладываясь сама на себя, должна создать такие гармонические созвучия, которые соответствуют биологической функции. Продолжая аналогию дальше, можно предположить, что белки с «разболтанными» дисульфидными мостиками, о которых я говорил выше, дают диссонантные созвучия, однако если возникает возможность перестройки при добавлении меркаптоэтанола, то путем постепенной модуляции вновь достигается та приятная гармония, которая свойственна нативному белку. Можно ли на этом основании считать, что музыка Моцарта обладает большей термодинамической устойчивостью, чем музыка Шёнберга, я предоставляю решить философам этой аудитории».
Рис. 2.47. Образование нативной рибонуклеазы из «разболтанной» в присутствии следовых количеств β-меркантоэтанола