БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 2. ОСНОВНЫЕ ПРЕДСТАВЛЕНИЯ О СТРУКТУРЕ И ФУНКЦИИ БЕЛКОВ
2.13. Формирование свернутой молекулы белков происходит путем ассоциации а-спиралей и складчатых β-слоев
Как возникает гармония при превращении развернутой полипептидной цепи в свернутую молекулу белка? A priori одна из возможностей состоит в том, что происходит перебор всех возможных конформаций и выбирается энергетически наиболее выгодная форма. Сколько времени займет такой случайный поиск стабильной структуры? Рассмотрим для примера небольшой белок из 100 аминокислотных остатков.
Если каждый остаток может принять 3 разные конформации, то общее число возможных структур составит З100, или 5 • 1047. Если превращение одной структуры в другую происходит за 10-13 с, то общее время поиска оптимальной конформации составит 5 • 1047 • 10-13 с, т.е. 5 • 1034с, или 1,6 • 1027 лет! Отметьте, что это время минимально, поскольку истинное число возможных конформаций в расчете на один остаток аминокислоты выше трех, а время, необходимое для перехода одной конформации в другую, вероятно, превышает 10-13 с. Совершенно очевидно, что даже для небольшого белка время выбора энергетически оптимальной конформации путем случайного перебора всех возможных слишком велико.
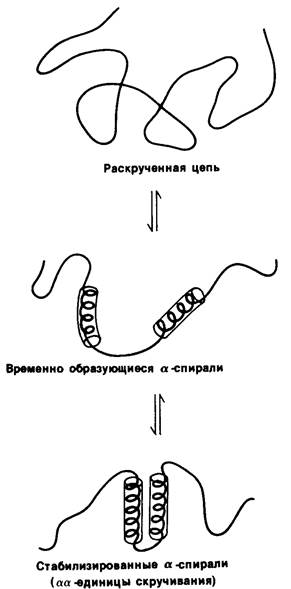
Как же получается, что белки принимают нужную конформацию в течение нескольких секунд или минут? Ответ пока неизвестен, но высказана довольно убедительная гипотеза, что важную роль в этом процессе играют небольшие участки вторичной структуры. Согласно предложенной модели, короткие отрезки (~ 15 аминокислотных остатков) развернутой полипептидной цепи образуют короткоживущие структуры: α-спирали или β-слои. Эти промежуточные структуры сближаются в результате диффузии и стабилизируют друг друга путем формирования комплексов (рис. 2.48). Допустим, что произошло сближение двух α-спиралей, или двух β-слоев, или α-спирали и β-слоя. Образовавшиеся комплексы αα, ββ или αβ, которые называют единицами скручивания, играют далее роль центров, стабилизирующих другие выступающие элементы вторичной структуры. Эта модель имеет ряд экспериментальных доказательств. Прежде всего, способность полипептида к образованию правильной вторичной структуры в значительной степени зависит от аминокислотного состава. Так, остатки глутамата, метионина, аланина и лейцина способствуют образованию а- спиралей, тогда как остатки валина, изолейцина и тирозина усиливают образование р-слоев. Во-вторых, переход от случайного клубка к α-спирали происходит менее чем за одну микросекунду. Следовательно, короткие участки вторичной структуры могут формироваться очень быстро. В-третьих, постулированные единицы скручивания (комплексы αα, ββ и αβ) представляют собой по существу основные элементы структуры белка. Задача в настоящее время состоит в том, чтобы непосредственно выявить и идентифицировать короткоживущие промежуточные структуры, образующиеся при специфическом скручивании полипептидной цепи, и таким образом воссоздать тот путь, который приводит к формированию функционально активной структуры белка.
Рис. 2.48. Предполагаемые этапы скручивания белков. Два участка в развернутой полипептидной цепи на какой-то момент принимают структуру α-спирали. Далее происходит стабилизация обеих спиралей благодаря образованию комплекса между этими участками