БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 3. ПЕРЕНОСЧИКИ КИСЛОРОДА—МИОГЛОБИН И ГЕМОГЛОБИН
3.2. Рентгеноструктурный анализ кристаллов выявляет пространственное расположение атомов
Выявление трехмерной структуры миоглобина Джоном Кендрью (J. Кеndrew) и гемоглобина Максом Перутцом (М. Рerutz) явилось выдающимся достижением молекулярной биологии. Эти исследования, успешно завершенные в конце 50-х годов, доказали применимость рентгеноструктурного анализа (рентгеноструктурной кристаллографии) для изучения структуры таких макромолекул, как белки. До 1957 г. самой большой из исследованных этим методом молекул был витамин В12, молекулярная масса которого на порядок меньше молекулярной массы миоглобина (17,8 кДа) или гемоглобина (66 кДа). Определение пространственной структуры этих белков послужило огромным стимулом для развития белковой кристаллографии. Проводятся исследования по установлению пространственной структуры большого множества различных белков. Более чем для 50 белков пространственная структура к настоящему времени изучена уже детально. Рентгеноструктурный анализ вносит большой вклад в наши представления о структуре и функции белков, потому что это единственный метод, выявляющий пространственное расположение большинства атомов в белке. Ценным источником информации о структуре биологических макромолекул может служить также электронная микроскопия, однако пока еще она не позволяет выявить архитектуру молекулы на уровне атомов.
Прежде чем обратиться непосредственно к пространственной структуре миоглобина и гемоглобина, рассмотрим некоторые основные аспекты метода рентгеноструктурного анализа. Прежде всего анализируемый белок должен быть выделен в кристаллическом виде. Миоглобин, например, кристаллизуется при добавлении сульфата аммония к концентрированному раствору белка (рис. 3.4). В концентрации 3 М сульфат аммония значительно снижает растворимость миоглобина и тем самым приводит к его кристаллизации. Растворимость большинства белков снижается при добавлении любых солей в высокой концентрации. Этот эффект называется высаливанием. Полученные таким образом кристаллы миоглобина (рис. 3.5) могут достигать нескольких миллиметров в длину.
Рис. 3.4. Кристаллизация миоглобина
Рис. 3.5. Фотография кристаллов миоглобина

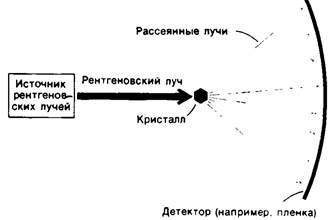
Для проведения рентгеноструктурного анализа необходимы три компонента: источник рентгеновских лучей, кристалл белка и детектор (рис. 3.6). Рентгеновское излучение с длиной волны 1,54 А получают путем бомбардировки медной мишени ускоренными электронами. Узкий пучок рентгеновских лучей направляется на кристалл белка. При этом часть пучка проходит через кристалл, не меняя своего направления, тогда как другая часть рассеивается в различных направлениях (дифракция лучей). Рассеянные пучки лучей попадают на фото пленку, причем степень потемнения эмульсии на пленке пропорциональна интенсивности падающих на нее лучей. В основе метода лежат следующие физические принципы:
1. Рентгеновские лучи рассеиваются электронами. Амплитуда волны, рассеиваемой атомом, пропорциональна числу электронов в атоме. Так, атом углерода рассеивает лучи в шесть раз сильнее, чем атом водорода.
2. Рассеянные волны взаимодействуют друг с другом (интерферируют). Каждый атом вносит свой вклад в отклонение каждого пучка лучей. Рассеянные волны могут усиливать или гасить друг друга в зависимости от того, совпадают они по фазе или нет.
3. Характер взаимодействия рассеянных волн целиком определяется расположением атомов в исследуемом веществе.
Рис. 3.6. Схема установки для проведения рентгеноструктурного анализа: рентгеновский луч, кристалл, детектор
3.3. Этапы рентгеноструктурного анализа миоглобина
Кендрью выбрал миоглобин для проведения рентгеноструктурного анализа в силу многих причин: это относительно небольшой белок (17,8 к Да), его легко получить в больших количествах, и он легко кристаллизуется. Кроме того, миоглобин имеет и то достоинство, что он очень сходен с гемоглобином, исследованием которого уже занимался коллега Кендрью Перутц. В работе был использован миоглобин из скелетных мышц кашалота, отличающийся стабильностью и способностью великолепно кристаллизоваться. Скелетные мышцы ныряющих млекопитающих-китов, тюленей, дельфинов-особенно богаты миоглобином, который служит для резервирования кислорода, используемого во время ныряния.
Кристалл миоглобина помещают в капилляр и строго ориентируют по отношению к пучку рентгеновских лучей и к пленке. В результате прецессионного движения кристалла на рентгеновском фотоснимке образуется регулярная решетка пятен (рефлексов). Рентгеновская фотография, показанная на рис. 3.7, представляет собой двумерное сечение через трехмерное множество рефлексов. Кристалл миоглобина дает 25 000 рефлексов. Измеряют интенсивность каждого рефлекса. Получаемые величины представляют собой те исходные экспериментальные данные рентгеноструктурного анализа, которыми оперируют далее.
Рис. 3.7. Рентгенограмма кристалла миоглобина

На следующем этапе воспроизводят структуру миоглобина, исходя из полученных значений интенсивности рефлексов: это производится с помощью математического метода представления сложных функций в виде гармонических рядов Фурье. Однако величины интенсивности рефлексов от кристаллов миоглобина дают только часть информации, необходимой для таких расчетов. Недостающие данные о фазах рассеянных пучков лучей получают из полной картины дифракции лучей кристаллом миоглобина, содержащего тяжелые атомы, например, уран или свинец, по одну или две стороны молекулы. После этого переходят к расчету карты электронных плотностей, используя быстродействующие ЭВМ. По счастью, развитие кристаллографических исследований миоглобина совпало по времени с появлением быстродействующих ЭВМ с большим объемом памяти. Окончательный расчет по методу рядов Фурье для миоглобина включал в себя около миллиарда величин.
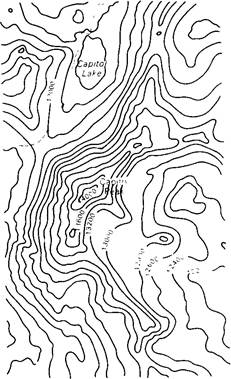
В результате проведенной математической обработки получают величины электронной плотности в большом числе регулярно расположенных в пространстве точек кристалла. При этом трехмерное распределение электронных плотностей имеет вид серии наслоенных один над другим параллельных срезов. Каждый срез представляет собой прозрачную пластинку из синтетического материала, на которой распределение электронных плотностей показано контурными линиями (рис. 3.8). Такое изображение можно сравнить с картой рельефа земной поверхности, на которой контурными линиями обозначается высота местности над уровнем моря (рис. 3.9).
Рис. 3.8. Часть карты электронной плотности миоглобина: участок гема. Пик в центре соответствует положению атома железа
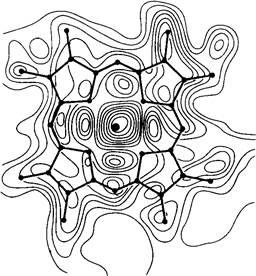
Рис. 3.9. Часть физической карты США; показан участок Капитол-пика, штат Колорадо
Следующий этап работы состоит в расшифровке карты электронных плотностей. Критическим фактором при этом выступает разрешающая способность метода рентгеноструктурного анализа, которая определяется количеством рефлексов, использованных в обратном преобразовании Фурье. Правильность изображения зависит от разрешающей способности обратного преобразования Фурье, как это показано с помощью оптической аналогии на рис. 3.10. Анализ миоглобина был выполнен в три этапа. На первом этапе, завершенном в 1957 г., анализу были подвергнуты только 400 внутренних рефлексов на дифракционной картине, что соответствовало разрешению 6 А. Как будет показано несколько ниже, такая карта электронных плотностей низкого разрешения описывает полипептидную цепь, но выявляет мало других деталей структуры. Дело в том, что из-за особенностей укладки полипептидных цепей их центры расходятся на 5-10 А. Чтобы выявить расположение групп атомов, отстоящих на 2,8-4,0 А друг от друга, или отдельных атомов, разделенных расстоянием в 1,0-1,5 А, требуются карты более высокого разрешения. В 1959 г. была получена карта миоглобина с разрешением 2 А (10000 рефлексов), а в 1962 г.-с разрешением 1,4 А (25000 рефлексов). Предел разрешающей способности рентгеноструктурного анализа определяется степенью совершенства структуры кристалла. Для белков этот предел обычно не ниже 2 А.
Рис.3.10. Влияние разрешающей способности на качество реконструированного изображения. Для иллюстрации использован оптический аналог дифракции рентгеновских лучей. Л-Парфенон, Б-картина дифракции от Парфенона, В и Г-изображения, полученные по данным, взятым из рис. Б. Для получения изображения, показанного на рис. Г, использовано больше точек, чем для получения изображения на рис. В. Соответственно изображение Г значительно выше качеством


В 1957 г. Кендрью и его сотрудники увидели то, чего до них никто не видел: пространственную структуру белковой молекулы во всей ее сложности. Модель, построенная на основании обратного преобразования Фурье с разрешением 6 А, состояла из набора отрезков высокой плотности, имеющих именно те размеры, какие и приписывались полипептидной цепи (рис. 3.11). Молекула имела очень компактный вид. Более подробное изучение показало, что она состоит из сложной и переплетающейся сети этих отрезков, которые то шли прямо на некотором протяжении, то делали угол, меняя направление. Расположение атома железа в геме было легко установить, так как железо содержит значительно больше электронов, чем любой другой атом в белке. Самое поразительное в структуре молекулы-это ее неправильность и полное отсутствие симметрии.