БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 3. ПЕРЕНОСЧИКИ КИСЛОРОДА—МИОГЛОБИН И ГЕМОГЛОБИН
3.4. Структура миоглобина характеризуется компактностью и высокой степенью α-спирализованности
Полученная двумя годами позже карта электронных плотностей миоглобина с высоким разрешением содержала колоссальное количество информации относительно деталей структуры белка. Из 1260 атомов, т.е. всех атомов, кроме водорода, положение 120 атомов было определено с точностью, превышающей 0,3 А. Общее расположение основной цепи и гема показано на рис. 3.12. Структура миоглобина имеет следующие особенности:
1. Молекула миоглобина чрезвычайно компактна. Ее объем равен 45 х 35 х 25 A. Внутри молекулы почти нет свободного пространства.
Рис. 3.11. Модель миоглобина, полученная при низком разрешении

Рис. 3.12. Модель миоглобина, полученная при высоком разрешении. Показаны в только α-углеродные атомы. Красным дан гем
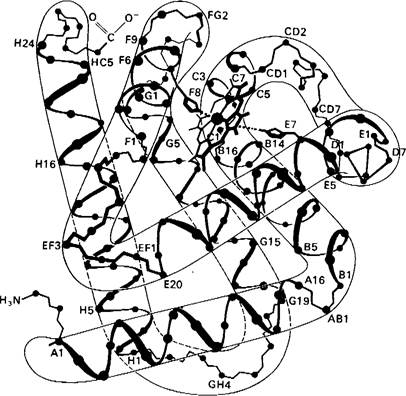
2. Около 75% основной цепи находится в конформации а-спирали. Все а-спирали правозакрученные. Имеется 8 основных участков спирализации, которые обозначены первыми 8 буквами латинского алфавита: А, В, С, ..., Н. Первый аминокислотный остаток в спирали А обозначают А1, второй А2 и т.д. (рис. 3.13). Между областями спирализации находится пять неспирализованных участков (обозначаемых, например, CD, если участок расположен между спиралями С и D). Имеются еще два неспирализованных участка: два аминокислотных остатка на N-конце молекулы (называемые NA1 и NA2) и пять остатков-на С-конце (обозначаются соответственно от НС1 до НС5).
Рис. 3.13. Аминокислотная последовательность миоглобина кашалота. Цифры и буквы под каждым остатком указывают на его положение в а-спиралях или в неспирализованных участках между ними. Например, В4 обозначает четвертый остаток в спирали В; EF7-7-й остаток в неспирализованном участке между спиралями Е и F

3. Не все факторы, определяющие терминирование участка спирализации, уже выявлены. Известно, однако, что важную роль в этом процессе играют остатки пролина. Пролин не может быть включенным в а-спираль (разве только одним концом), потому что пятичленное пирролидоновое кольцо просто не может в ней уместиться. В миоглобине содержится четыре остатка пролина и восемь окончаний а-спиральных участков. Ясно, что имеются и другие факторы, определяющие завершение спирали. Так, например, в отдельных случаях происходит прерывание а-спирали, если ОН-группа серина или треонина взаимодействует с карбонильной группой основной цепи.
4. Пептидные группы имеют планарную структуру. Карбонильная группа занимает трансположение относительно NH-группы основной цепи. Длина связей и углы между ними соответствуют таковым в дипептидах и близких к ним соединениях.
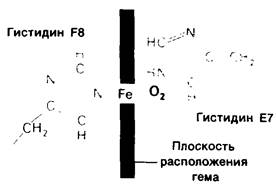
5. Четко различаются внутренняя и наружная части молекулы. Внутренняя часть молекулы почти целиком состоит из неполярных остатков лейцина, валина, метионина, фенилаланина и не содержит боковых цепей глутаминовой и аспарагиновой кислот, глутамина, аспарагина, лизина или аргинина. Аминокислотные остатки, имеющие полярную и неполярную части, а именно треонин, тирозин и триптофан ориентированы так, что внутрь обращены их неполярные участки. Есть только два полярных остатка внутри молекулы миоглобина-это два гистидина, расположенные в активном центре и играющие главную роль в функциональной активности. На наружной стороне молекулы расположены как полярные, так и неполярные аминокислотные остатки.