БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 6. ВВЕДЕНИЕ В ЭНЗИМОЛОГИЮ
6.3. Активность некоторых ферментов регулируется
Некоторые ферменты синтезируются в форме неактивного предшественника и переходят в активное состояние в физиологически соответствующем месте и времени. Примером регуляции такого типа могут служить пищеварительные ферменты. Так, трипсиноген синтезируется в поджелудочной железе, а активируется в тонком кишечнике, где в результате расщепления пептидной связи образуется активная форма - трипсин (рис. 6.4). Такой же тип регуляции многократно используется в последовательности ферментативных реакций, ведущих к свертыванию крови. Каталитически неактивные предшественники протеолитических ферментов называются проферментами, или зимогенами.
Рис. 6.4. Активация профермента путем гидролиза специфических пептидных связей

Еще один механизм регуляции ферментативной активности заключается в том, что с ферментом ковалентно связывается небольшая дополнительная группа. Это так называемый механизм ковалентной модификации. Так, в частности, путем присоединения фосфорильной группы к определенным остаткам серина регулируется активность ферментов (разд. 16.11), синтезирующих или расщепляющих гликоген.
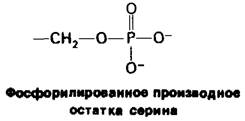
Такая модификация может быть обращена гидролизом. Как присоединение, так и отщепление фосфорильных и других модифицирующих групп катализируется специфическими ферментами.
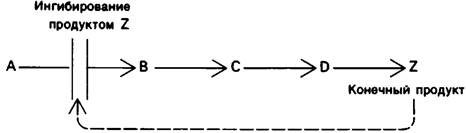
Иной тип регуляции действует в случае многих метаболических последовательностей, ведущих к синтезу небольших молекул, например, аминокислот. При этом фермент, катализирующий первый этап биосинтеза, подвергается ингибирующему действию конечного продукта биосинтеза (рис. 6.5). Иллюстрацией этого механизма регуляции - ингибирования по принципу обратной связи, или ретроингибирования, может служит биосинтез изолейцина у бактерий. Превращение треонина в изолейцин осуществляется в пять этапов, первый из которых катализируется треониндезаминазой. Когда концентрация изолейцина достигает достаточно высокого уровня, происходит ингибирование фермента, обусловленное тем, что изолейцин присоединяется к регуляторному (а не к каталитическому) участку фермента. Ингибирование фермента в этом случае опосредовано обратимым аллостерическим взаимодействием. При снижении содержания изолейцина до определенного уровня треониндезаминаза вновь становится активной и синтез изолейцина восстанавливается.
Рис. 6.5. Ингибирование по механизму обратной связи первого в метаболической последовательности фермента путем обратимого связывания им конечного продукта
Специфичность ряда ферментов находится под физиологическим контролем. Особенно интересным примером в этом отношении может служить синтез лактозы в молочной железе (рис. 6.6). Лактозосинтаза - фермент, катализирующий синтез лактозы, состоит из двух субъединиц-каталитической и модифицирующей. Каталитическая субъединица сама по себе неспособна к синтезу лактозы. Роль этой субъединицы состоит в том, что она катализирует присоединение галактозы к белку, содержащему ковалентно присоединенную углеводную цепь.
Рис. 6.6. Синтез лактозы - сахара, состоящего из остатков глюкозы и галактозы, происходит под действием фермента, который содержит каталитическую субьединицу и субъединицу, модифицирующую субстратную специфичность. Каталитическая субъединица в отсутствие субъединицы-модификатора катализирует другую реакцию
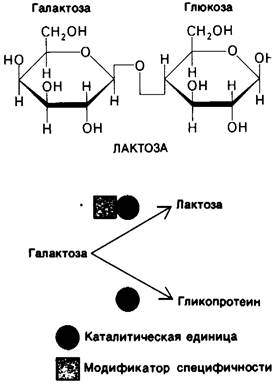
Модифицирующая субъединица меняет специфичность каталитической субъединицы таким образом, что последняя начинает присоединять галактозу уже к глюкозе, образуя лактозу. Содержание модифицирующей субъединицы находится под гормональным контролем. Во время беременности в молочной железе синтезируется каталитическая субъединица, содержание же модифицирующей субъединицы незначительно. При родах содержание гормонов в крови резко меняется, что приводит к синтезу больших количеств модифицирующей субъединицы. Далее модифицирующая субъединица присоединяется к каталитической, образуя активный лактозо-синтазный комплекс, продуцирующий большие количества лактозы. Из всего сказанного очевидно, что гормоны могут оказывать физиологический эффект путем изменения специфичности ферментов.