БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 6. ВВЕДЕНИЕ В ЭНЗИМОЛОГИЮ
6.4. Ферменты осуществляют трансформацию различных видов энергии
Во многих биохимических реакциях энергия реагирующих веществ переходит из одной формы в другую с высокой степенью эффективности. Так, например, при фотосинтезе энергия света превращается в энергию химических связей. В митохондриях свободная энергия, содержащаяся в низкомолекулярных веществах, поступающих с пищей, переходит в энергию аденозинтрифосфата (АТР) - разменной монеты энергетической валюты. Энергия химических связей АТР используется далее во многих процессах. При мышечном сокращении энергия АТР преобразуется в энергию мышечного сокращения. В клетках и в субклеточных органеллах имеются насосы, использующие АТР для транспорта молекул и ионов против химического и электрического градиентов. Эти превращения энергии осуществляются молекулами ферментов, составляющими интегральную часть высокоорганизованных структур.
6.5. Ферменты не сдвигают равновесия реакции
Фермент является катализатором, и, следовательно, он не может изменять равновесия химической реакции. Это означает, что фермент ускоряет как прямую, так и обратную реакцию в совершенно одинаковой степени. Рассмотрим взаимопревращение А в В. Пусть в отсутствие фермента скорость прямой реакции (кпр составит 10-4 с-, а скорость обратной (кобр) составит 10-6 с-1.
Константа равновесия К определяется соотношением этих скоростей:
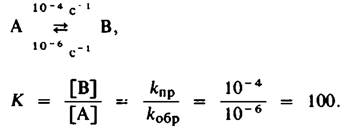
Таким образом, в состоянии равновесия концентрация В будет в 100 раз выше, чем концентрация А, независимо от того, присутствует фермент или нет. Однако в отсутствие фермента равновесие установится лишь через несколько часов, тогда как при участии фермента оно будет достигнуто всего лишь за несколько секунд. Следовательно, ферменты ускоряют наступление равновесия, но не сдвигают его.
6.6. Ферменты снижают энергию активации катализируемых ими реакций
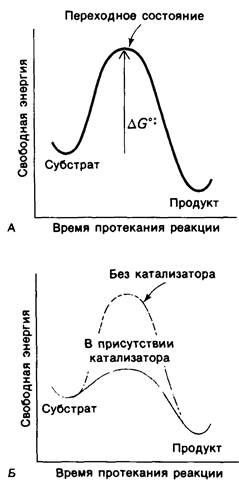
Химическая реакция А+±!!!!В протекает через переходное состояние с более высокой энергией, чем энергия А или В. Скорость прямой реакции зависит от температуры и от разности значений свободной энергии для А и переходного состояния; эта разность называется свободной энергией активации Гиббса и обозначается
![]() (рис. 6.7, А):
(рис. 6.7, А):
![]()
Скорость реакции пропорциональна количеству молекул, свободная энергия которых равна или выше ![]() . Доля таких молекул возрастает с повышением температуры.
. Доля таких молекул возрастает с повышением температуры.
Ферменты повышают скорость реакций путем снижения активационного барьера ![]() . При взаимодействии субстрата с ферментом реакция протекает по новому механизму, характеризующемуся более низкой энергией переходного состояния, чем реакции, протекающие в отсутствие фермента (рис. 6.7, Б).
. При взаимодействии субстрата с ферментом реакция протекает по новому механизму, характеризующемуся более низкой энергией переходного состояния, чем реакции, протекающие в отсутствие фермента (рис. 6.7, Б).
Рис. 6.7. A. Определение свободной энергии активации ![]() . Б. Фермент ускоряет реакцию путем снижения
. Б. Фермент ускоряет реакцию путем снижения ![]()
6.7. Первый этап ферментативного катализа - образование фермент-субстратного комплекса
Образованию или расщеплению химических связей каким-либо ферментом предшествует формирование фермент-субстратного (ЕS) комплекса. При этом субстрат присоединяется к специфическому участку на ферменте, называемому активным центром. Большинство ферментов проявляет высокую избирательность в отношении связывания субстратов. В сущности, специфичность каталитического действия ферментов в основном зависит от специфичности процесса связывания. Более того, на этой стадии нередко осуществляется и регуляция ферментативной активности.
Существование фермент-субстратных комплексов было доказано разными способами.
1. ЕS-комплексы были непосредственно выявлены с помощью электронной микроскопии и рентгеноструктурного анализа. Комплексы нуклеиновых кислот и их полимераз видны под электронным микроскопом (рис. 6.3). При рентгеноструктурном анализе комплекса карбоксипептидазы А с ее субстратом глицин-L-тирозином была получена подробная информация относительно места и характера связывания субстрата с ферментом в этом ЕS-комплексе.
2. При образовании ЕS-комплекса нередко изменяются физические свойства фермента, например, растворимость или термостабильность.
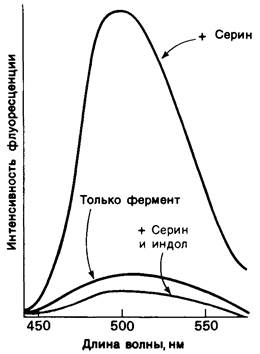
3. Спектроскопические характеристики многих ферментов и субстратов изменяются при образовании ЕS-комплекса подобно тому, как меняется характерный для дезоксигемоглобина спектр поглощения при связывании кислорода или при окислении в ферриформу, что было описано ранее (рис. 3.18). Эти изменения проявляются особенно отчетливо, если фермент содержит окрашенную простетическую группу. Хорошей иллюстрацией может служить триптофан-синтаза-бактериальный фермент, содержащий в качестве простетической группы пиридоксальфосфат. Этот фермент катализирует синтез L-триптофана из L-серина и индола. При добавлении L-серина к ферменту резко возрастает флуоресценция пиридоксальфосфатной группы (рис. 6.8). Последующее добавление второго субстрата - индола - гасит флуоресценцию до уровня ниже исходного. Таким образом, флуоресцентная спектроскопия позволяет выявить существование комплексов фермент—серин и фермент—серин—индол. Для изучения фермент-субстратного взаимодействия с успехом применяются и другие спектроскопические методы, в частности методы ядерного и электронного парамагнитного резонанса.
Рис. 6.8. При добавлении субстратов реакции-серина и индола-изменяется интенсивность флуоресценции пиридоксальфосфатной группы в активном центре триптофан-синтазы
4. При образовании ЕS-комплекса проявляется высокая степень стереоспецифичности. Например, D-серин не может служить субстратом для триптофан-синтазы. Более того, D-изомер даже не связывается с ферментом. Из этого следует, что участок связывания субстрата имеет строго определенную геометрическую форму.
5. ЕS-комплексы удается иногда выделить в чистом виде. Если фермент катализирует реакцию А + В ⇄ С, то в некоторых случаях можно выделить комплекс ЕА. Для этого необходимо, чтобы фермент обладал достаточно высоким сродством к А и чтобы В в смеси отсутствовал.
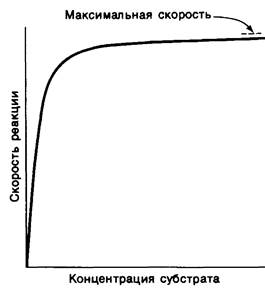
6. При постоянной концентрации фермента скорость реакции возрастает с увеличением концентрации субстрата, пока не будет достигнута максимальная скорость
(рис. 6.9). Такой эффект насыщения не свойствен реакциям, протекающим без катализатора. В 1913 г. Леонор Михаэлис (L. Michaelis) рассмотрел понятие максимальной скорости ферментативной реакции с позиций образования дискретного ES-kom- плекса. Михаэлис пришел к выводу, что скорость реакции достигает максимума при достаточно высокой концентрации субстрата, так как в этих условиях субстрат занимает все каталитические центры на ферменте. Это положение является самым старым и наиболее общим доводом в пользу существования ES-комплексов.
Рис. 6.9. Скорость ферментативной реакции как функция концентрации субстрата