БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 6. ВВЕДЕНИЕ В ЭНЗИМОЛОГИЮ
6.14. Конкурентное и неконкурентное ингибирование различаются по кинетике
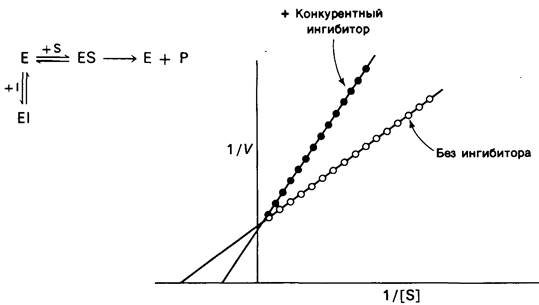
Измерение скоростей катализа при разных концентрациях субстрата дает возможность отличить конкурентное ингибирование от неконкурентного. При конкурентном ингибировании на графике, где 1/V отложена против 1/[S], прямая пересекает ось ординат в одной и той же точке независимо от присутствия ингибитора; меняется только угол наклона прямой (рис. 6.17). Это показывает, что при конкурентном ингибировании Vmах не изменяется. Особенность конкурентного ингибирования состоит в том, что при достаточно высокой концентрации субстрата ингибирование может быть преодолено. В самом деле, субстрат и ингибитор конкурируют за один и тот же участок. При достаточно высокой концентрации субстрата почти все активные центры заняты субстратом и фермент проявляет полную активность. Увеличение угла наклона прямой на графике зависимости 1/Vот 1/[S] указывает на прочность связи конкурентного ингибитора. В присутствии конкурентного ингибитора уравнение (16) заменяется следующим:
![]() (24)
(24)
где [I] — концентрация ингибитора, а Кi-константа диссоциации комплекса фермент -ингибитор
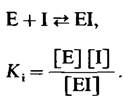 (25)
(25)
Другими словами, в присутствии конкурентного ингибитора наклонпрямой увеличивается на величину![]() Рассмотрим фермент Км, равной 10-4 М. В отсутствие ингибитора V = Vmах/2 при [S] = 10-4 М. В присутствии 2 • 10-3 М конкурентного ингибитора, связывающегося с ферментом с Ki=10-3М, кажущаяся Км составит 3 • 10-4 М. Отсюда V = Vmах/4.
Рассмотрим фермент Км, равной 10-4 М. В отсутствие ингибитора V = Vmах/2 при [S] = 10-4 М. В присутствии 2 • 10-3 М конкурентного ингибитора, связывающегося с ферментом с Ki=10-3М, кажущаяся Км составит 3 • 10-4 М. Отсюда V = Vmах/4.
Рис. 6.17. Кинетика ферментативной реакции на графике двойных обратных величин в присутствии![]() или в отсутствие
или в отсутствие ![]() конкурентного ингибитора. Vmах не меняется, Кмвозрастает
конкурентного ингибитора. Vmах не меняется, Кмвозрастает
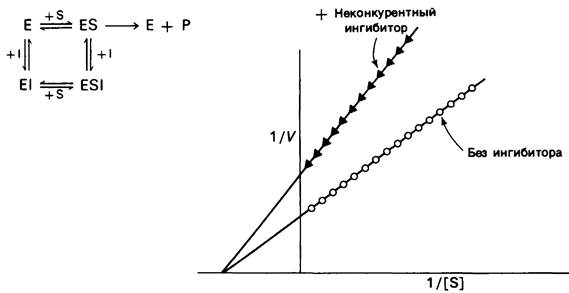
При неконкурентном ингибировании (рис. 6.18) Vmах уменьшается, а это значит, что пересечение прямой с осью ординат произойдет в более высокой точке. В той же мере возрастает и наклон прямой, равный Kм/V1mах- в отличие от Vmax Км не изменяется при этом виде ингибирования. Повышение концентрации субстрата не снимает неконкурентного ингибирования. Максимальная скорость реакции VImax в присутствии неконкурентного ингибитора задается уравнением
![]() (26)
(26)
Рис. 6.18. Кинетика ферментативной реакции на графике двойных обратных величин в присутствии![]() или в отсутствие (О—О) неконкурентного ингибитора. Неконкурентный ингибитор не влияет на Км, но снижает Vmах
или в отсутствие (О—О) неконкурентного ингибитора. Неконкурентный ингибитор не влияет на Км, но снижает Vmах
6.15. Лечение отравления этиленгликолем на основе конкурентного ингибирования
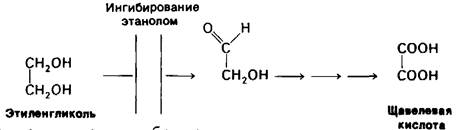
Ежегодно около 50 человек погибают от отравления этиленгликолем-добавки в антифриз для автомобильных двигателей. Сам по себе этиленгликоль не обладает летальной токсичностью. Собственно, ядом является продукт его окисления-щавелевая кислота. Первый этап превращения-окисление этиленгликоля алкогольдегидрогеназой (рис. 6.19). Эту реакцию можно эффективно затормозить путем введения большой, почти токсичной дозы этанола. Механизм действия состоит в том, что этанол оказывается конкурентным субстратом и потому блокирует окисление этиленгликоля в альдегидные производные. Этиленгликоль при этом выводится, не причиняя вреда. Такой же принцип лежит в основе лечения метанольного отравления.
Рис. 6.19. Этанол подавляет образование щавелевой кислоты из этиленгликоля
6.16. Аллостерические ферменты не подчиняются кинетике Михаэлиса-Ментен
Модель Михаэлиса-Ментен оказала большое влияние на развитие энзимологии. Достоинство этой модели - в простоте и широкой применимости. Все же не все ферменты подчиняются кинетике Михаэлиса-Ментен. В первую очередь-это большая группа аллостерических ферментов, для которых зависимость скорости реакции V от концентрации субстрата [S] имеет сигмоидную форму, а не гиперболическую, как предсказывает уравнение Михаэлиса-Ментен [уравнение (15)]. Вспомним, что кривая связывания кислорода для миоглобина-гиперболическая, тогда как для гемоглобина-сигмоидная. Ситуация с ферментами совершенно аналогична. В аллостерических ферментах один активный центр в молекуле фермента оказывает влияние на другой активный центр в той же молекуле. В результате такого взаимодействия между субъединицами связывание субстрата становится кооперативным, и кривая зависимости V от [S] приобретает сигмоидную форму. Кроме того, активность аллостерических ферментов может регулироваться воздействием определенных молекул, связывающихся с ферментом в некаталитических участках, подобно тому, как на связывание кислорода гемоглобином влияют бисфосфоглицерат, Н+ и СO2.