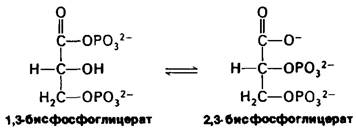БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 6. ВВЕДЕНИЕ В ЭНЗИМОЛОГИЮ
6.12. О степени совершенства кинетики ферментативного катализа судят по критерию ккат/Км
Когда концентрация субстрата намного превышает Км, скорость катализа численно равна к3, т. е. числу оборотов, как это описано в предыдущем разделе. Однако в физиологических условиях концентрации субстратов в большинстве случаев ниже насыщающих. Отношение [S]/Км обычно колеблется от 0,1 до 1,0. Если [S] « Км, то скорость ферментативной реакции значительно ниже к3, поскольку большинство активных центров остается свободным. Существуют ли такие параметры, с помощью которых можно описать кинетику ферментативных реакций в этих условиях? Такие параметры имеются и их можно получить, объединив уравнения (2) и (8):
![]() (21)
(21)
Если [S] « Км, то концентрация свободного фермента (Е) практически равна общей концентрации фермента [Ет], и тогда
![]() (22)
(22)
Таким образом, при [S] « Км скорость ферментативной реакции зависит от величины к3/Км и от [S].
В каких границах лежит отношение к3/Км? Обратите внимание, что оно зависит от к1, к2 и к3, как можно это показать путем замещения Км:
![]() (23)
(23)
Предел, которого может достичь отношение к3/Км, определяется значением к1, т.е. скоростью образования комплекса ЕS. Эта скорость не может превышать число столкновений фермента с субстратом, контролируемое скоростью диффузии. Из-за этого нагадываемого диффузией ограничения значение к3 не может быть выше 108-109 М-1с-1. Отсюда следует, что верхний предел отношения к3/Км составляет 108-109 М-1с-1.
Это ограничение сохраняет свою силу и применительно к ферментам, имеющим более сложный механизм реакции, чем тот, что описан в уравнении (1). В случае таких ферментов максимальная скорость катализа при насыщающих концентрациях субстрата, обозначаемая kкат, зависит не от одной к3, а от нескольких констант скоростей. Параметром, характеризующим эти ферменты, является kкат/Kм. Для ряда ферментов, в частности для ацетилхолинэстеразы, карбоангидразы и триозофосфатизомеразы, отношение ккат1т/Км колеблется от 108 до • 109 М-1 с-1, что свидетельствует о достижении ими практически совершенной кинетики: скорость катализируемых ими реакций ограничивается только частотой столкновения фермента с субстратом. Дальнейшее повышение скорости реакции возможно только на основе уменьшения времени диффузии. В действительности часто бывает так, что ферменты, обеспечивающие отдельные метаболические последовательности, организованы в сложные комплексы (разд. 13.10), благодаря чему продукт реакции, катализируемой одним ферментом, быстро попадает на следующий фермент. Таким образом, ограничения, накладываемые скоростью диффузии в растворе, частично снимаются тем обстоятельством, что субстраты и продукты оказываются в малом объеме на полиферментном комплексе.
6.13. Ферменты могут ингибироваться специфическими молекулами
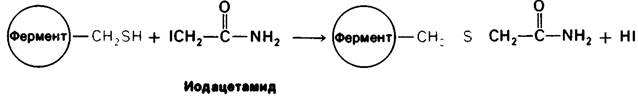
Ингибирование ферментативной активности небольшими специфическими молекулами и ионами имеет очень важное значение, поскольку в биологических системах служитосновным механизмом контроля. Подавление ферментативной активности лежит также в основе действия многих лекарственных веществ и токсических агентов. Наконец, анализ ингибирования ферментов является одним из подходов к изучению механизмов ферментативного действия. Ингибирование ферментов может быть, как обратимым, так и необратимым. При Необратимом ингибировании ингибитор ковалентно соединяется с ферментом или же связывается так прочно, что диссоциация идет очень медленно. Пример необратимого ингибирования— действие нервнопаралитических ядов на ацетилхолинэстеразу, играющую важную роль в передаче нервных импульсов. Одно из таких отравляющих веществ -диизопропилфторфосфат - взаимодействует с имеющим критическое значение остатком серина в активном центре фермента с образованием неактивного комплекса диизопропилфосфорил—фермент (рис. 6.14). Алкилирующие агенты, например, иодоацетамид, способны к необратимому ингибированию ферментов путем модификации цистеина и других боковых цепей (рис. 6.15).
Рис. 6.14. Инактивация химотрипсина и ацетилхолин эстеразы диизопропил фторфосфатом
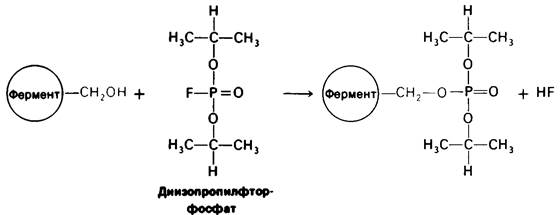
Рис. 6.15. Инактивация иодоацетатом фермента, для активации которого остаток цистеина имеет критическое значение
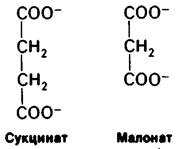
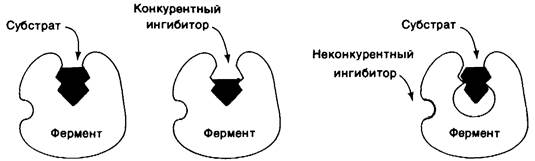
В отличие от рассмотренной ситуации при обратимом ингибировании равновесие между ингибитором и ферментом устанавливается быстро. Простейший вид обратимого ингибирования-это конкурентное ингибирование. Конкурентный ингибитор похож на субстрат и потому связывается активным центром фермента (рис. 6.16). Это препятствует связыванию субстрата в том же активном центре. Иными словами, невозможно одновременное связывание субстрата и конкурентного ингибитора. Конкурентный ингибитор уменьшает скорость катализа путем снижения доли молекул фермента, связавших субстрат. Классический пример конкурентного ингибирования-действие малоната на сукцинат-дегидрогеназу-фермент, отщепляющий от сукцината ионы водорода. Малонат отличается от сукцината тем, что имеет не две метильные группы, а одну:
Физиологически важный пример конкурентного ингибирования связан с образованием 2,3-бисфосфоглицерата из 1,3-бисфосфоглицерата. Фермент, катализирующий эту изомеризацию, бисфосфоглицератму- таза-конкурентно ингибируется низкими концентрациями 2,3-бисфосфоглицерата.
Рис. 6.16. Различие между конкурентным и неконкурентным ингибитором: слева- фермент-субстратный комплекс; в середине-конкурентный ингибитор препятствует связыванию субстрата; справа - неконкурентный ингибитор не препятствует связыванию субстрата
В сущности, это довольно обычное явление, когда продукт ферментативной реакции ведет себя как конкурентный ингибитор в силу структурного сходства с субстратом.
При неконкурентном, но тоже обратимом ингибировании ингибитор и субстрат могут связываться молекулой фермента одновременно; само по себе это показывает, что участки их связывания не перекрываются. Действие неконкурентного ингибитора заключается в уменьшении числа оборотов фермента, а не в снижении доли связавших субстрат молекул фермента. Возможны и более сложные механизмы ингибирования, когда ингибитор влияет и на связывание субстрата, и на число оборотов фермента.
Активность фермента может быть ингибирована также в результате взаимодействия между разными субъединицами олигомерного фермента. Этот тип ингибирования, называемый аллостерическим ингибированием, имеет очень важное значение для физиологических процессов. Мы его рассмотрим несколько ниже.