БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 6. ВВЕДЕНИЕ В ЭНЗИМОЛОГИЮ
6.10. Vmax и Км можно определить, используя различные концентрации субстрата
Если фермент работает в соответствии с простой схемой, представленной в уравнении (1), то нетрудно определить его константу Михаэлиса Км и максимальную скорость Vmaxпутем измерения скорости реакции при различных концентрациях субстрата. Удобно преобразовать уравнение Михаэлиса— Ментен в такую форму, чтобы графически оно выражалось прямой. Для этого уравнение (15) представляют в виде обратных величин:
![]() (16)
(16)
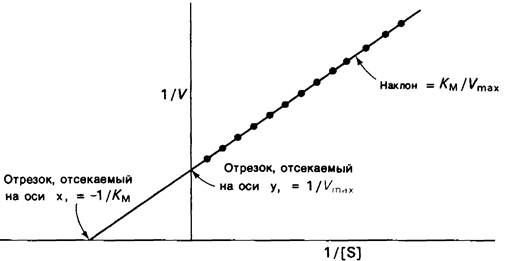
Откладывая 1/V против 1/[S], получаем прямую, пересечение которой с осью ординат дает 1/Vmax, а угол наклона равен Км/Vmax (рис. 6.13).
Рис. 6.13. Изображение кинетики ферментативной реакции на графике двойных обратных величин: 1/V выражена как функция 1/[S]. Наклон кривой равен K/M/Vmах, точка пересечения с осью у соответствует 1/Vmах, точка пересечения с осью X = 1 /Км
6.11. Значение величин Км и Vmах
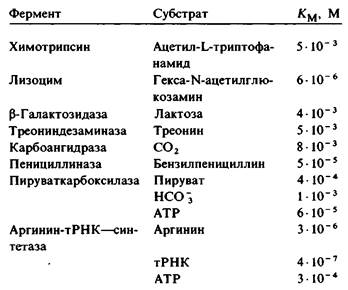
Км для разных ферментов варьирует в широком диапазоне величин (табл. 6.1). Для большинства ферментов величина Км лежит в пределах 10-1 — 10-6 М. Значение Км фермента зависит от природы субстрата, а также от условий среды: температуры, ионной силы. Константа Михаэлиса Км имеет два смысловых значения. Во-первых, Км-это концентрация субстрата, при которой занята половина активных центров фермента. Если известна Км, то можно рассчитать, какова доля занятых активных центров ƒES для любой концентрации субстрата:
![]() (17)
(17)
Таблица 6.1. Величины Км некоторых ферментов
Во-вторых, Км связана с константами скоростей отдельных этапов катализа, представленных в уравнении (1). Согласно уравнению (7), Км равна (к2+к3)/к1. Рассмотрим крайний случай, когда к2 намного выше к3, т.е. диссоциация комплекса ЕS на Е и S происходит гораздо быстрее, чем образование Е плюс продукта реакции. В этих условиях (к2 » к3)
![]() (18)
(18)
Константа диссоциации комплекса ЕS описывается уравнением
![]() (19)
(19)
Другими словами, если к3 намного меньше, чем к2, то Км равна константе диссоциации ЕS-комплекса. При указанном условии Км служит мерой прочности ЕS-комплекса: высокая Км-показатель слабого связывания субстрата; низкая Км - показатель сильного фермент-субстратного взаимодействия. Следует еще раз подчеркнуть, что по значению Км можно судить о сродстве фермента к субстрату только при условии, что к2 значительно больше к3. В действительности так оно и бывает во многих, хотя и не во всех случаях.
Максимальная скорость Vmax отражает число оборотов фермента, если известна концентрация активных центров (ET), так как
Vmax = kз [EТ]. (20)
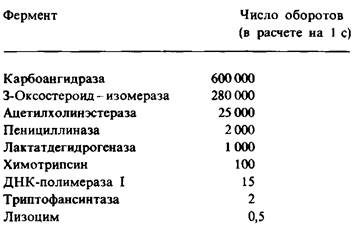
Например, при полном насыщении субстратом растворенная карбоангидраза в концентрации 10-6 М катализирует образование 0,6 М Н2СО3 в секунду. Отсюда к3 = 6 • 10-5 с-1. Кинетическая константа к3 называется числом оборотов. Число оборотов фермента, это то количество молекул субстрата, которое превращается в продукт реакции в единицу времени при полном насыщении фермента субстратом. Число оборотов 6 • 105 с-1, характерное для карбоангидразы, самое большое из всех известных. Каждый новый каталитический акт происходит через промежуток времени, равный 1/k3, что для карбоангидразы составляет 1,7 мкс. Число оборотов большинства ферментов при использовании физиологических субстратов находится в пределах 104 в секунду (табл. 6.2).
Таблица 6.2. Максимальное число оборотов некоторых ферментов