БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 6. ВВЕДЕНИЕ В ЭНЗИМОЛОГИЮ
6.9. Кинетика многих ферментов описывается моделью Михаэлиса - Ментен
Для многих ферментов скорость катализа К, таким образом, зависит от концентрации субстрата [S], как это показано на рис. 6.12. При постоянной концентрации фермента и малых значениях [S] V почти прямо пропорциональна [S]. При высоких значениях [S] V почти не зависит от [S]. В 1913 г. Леонор Михаэлис и Мод Ментен (L. Michaelis, М. Menten) предложили простую модель, объясняющую такую кинетику. Основная их посылка состояла в том, что образование специфического фермент-субстратного комплекса является необходимым промежуточным этапом катализа. Предложенная ими модель, которая простейшим образом описывает кинетические свойства многих ферментов, состоит в следующем:
![]() (1)
(1)
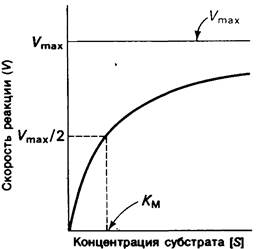
Рис. 6.12. График зависимости скорости реакции V от концентрации субстрата [S] для фермента, подчиняющегося кинетике Михаэлиса - Ментен (Vmах- максимальная скорость, Км- константа Михаэлиса)
Фермент Е соединяется с субстратом S, образуя ЕS-комплекс; константа скорости этого процесса - k1. Судьба ЕS-комплекса складывается двояко: он может либо диссоциировать на Е и S с константой скорости к2, либо подвергаться дальнейшему превращению, образуя продукт Р, с константой скорости к3. Постулируется, что продукт реакции Р не превращается в исходный субстрат S; это условие соблюдается на начальной стадии реакции, пока концентрация продукта не достигает ощутимого количества.
Как связана скорость катализа с концентрацией субстрата и фермента и скоростями отдельных этапов реакции? Начнем с того, что скорость ферментативной реакции равна произведению концентрации комплекса ЕS на константу к3:
V = к3 [ЕS]. (2)
Выразим [ЕS] через известные величины. Скорости образования и распада ЕS составляют:
Скорость образования ЕS =k1 [Е] [S]. (3)
Скорость распада ЕS = (к2 + к3) [ЕS]. (4)
Определим скорость катализа в стационарных условиях. Стационарные условия характеризуются тем, что концентрация промежуточных продуктов остается постоянной, тогда как концентрации исходных и конечных продуктов меняются. Это имеет место в том случае, когда скорость синтеза ЕS-комплекса оказывается равной скорости его распада. Если левые части равенств (3) и (4) равны между собой, то равны и правые, т. е.
k1 [Е] [S] = (к2 + к3) [ЕS]. (5)
Преобразуем это уравнение:
![]() (6)
(6)
Уравнение (6) можно упростить, если ввести новую константу Км, называемую константой Михаэлиса:
![]() (7)
(7)
Введем Км в уравнение (6):
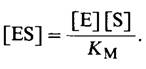 (8)
(8)
Рассмотрим числитель в последнем выражении. Концентрация несвязанного субстрата [S] практически равна общей концентрации субстрата при условии, что концентрация фермента значительно ниже концентрации субстрата. Концентрация несвязанного фермента (Е) равна общей концентрации фермента Ет минус концентрация комплекса ЕS:
[Е]=[ЕТ]-[ЕS]. (9)
Подставим это выражение в уравнение (8):
[ЕS] = ([Ет] — [ЕS]) [S]/KМ (10)
Решение уравнения (10) относительно [ЕS] дает
![]() (11)
(11)
или
![]() (12)
(12)
Подставим выражение (12) в уравнение (2):
![]() (13)
(13)
Максимальная скорость реакции Vmах достигается при насыщении активных центров фермента субстратом, т.е, когда [S] намного выше Км; при этом условии [S]/([S] + Км) приближается к единице. Следовательно,
Vmax = kз [Ет]. (14)
Подставив это выражение в выражение (13), мы получим уравнение Михаэлиса-Ментен:
![]() (15)
(15)
Это уравнение соответствует кинетическим данным, представленным на рис. 6.12. При низких концентрациях субстрата, когда [S] намного ниже Kм, V = [S] Vmax/Км, т.е. скорость прямо пропорциональна концентрации субстрата. При высоких концентрациях субстрата, когда [S] намного выше, чем Км, V = Vmax, т. е. скорость реакции максимальна и не зависит от концентрации субстрата.
Значение Км выступает с очевидностью из уравнения (15). Если [s] = Км, то V = Vmax/2. Таким образом, Км равна концентрации субстрата, при которой скорость реакции составляет половину максимальной.