БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 6. ВВЕДЕНИЕ В ЭНЗИМОЛОГИЮ
6.18. Последовательный механизм аллостерического взаимодействия
Аллостерические взаимодействия можно описать также с помощью модели последовательного механизма, разработанной Даниелем Кошландом (D. Koshland). В основу модели в простейшем случае положены три постулата.
1. Каждая субъединица может существовать в одном из двух возможных конформационных состояний (R или Т).
2. Связывание субстрата изменяет форму той субъединицы, к которой он присоединяется. Конформация другой субъединицы при этом существенно не меняется.
3. Конформационные изменения, вызванные связыванием субстрата на одной субъединице, могут увеличивать или уменьшать сродство к субстрату другой субъединицы той же молекулы фермента.
Согласно модели последовательного механизма, процесс связывания субстрата аллостерическим ферментом протекает так, как показано на рис. 6.24. Связывание является кооперативным, если у RT-формы сродство к субстрату выше, чем у ТТ- формы.
Рис. 6.24. Модель последовательного механизма кооперативного связывания субстрата аллостерическим ферментом. Свободный активный центр RТ- формы обладает большим сродством к субстрату, чем активные центры ТТ-формы
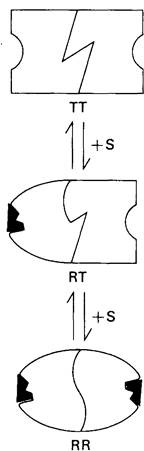
Модель простого последовательного механизма взаимодействия отличается от модели согласованного механизма в нескольких отношениях. Во-первых, модель последовательного механизма не предполагает равновесия между R- и Т-формами в отсутствие субстрата. Напротив, присоединение субстрата индуцирует переход от Т к R. Во- вторых, конформационный переход от Т к R в разных субъединицах фермента происходит не согласованно, а последовательно. Гибридной форме RT отводится важная роль в модели последовательного механизма. В модели согласованного механизма наличие гибридной формы RT исключается. Эта модель исходит из важной роли симметрии во взаимодействии субъединиц в олигомерных белках и потому предполагает ее сохранение при аллостерических переходах. Модель же последовательного механизма, напротив, построена на предположении, что субъединицы могут взаимодействовать, даже если они находятся в разных конформационных формах. Наконец, различие заключается также и в том, что в случае согласованного механизма гомотропные взаимодействия всегда должны быть положительными, тогда как в случае последовательного механизма они могут быть либо положительными, либо отрицательными. Будет ли вторая молекула субстрата связываться с ферментом более или же менее прочно, чем первая, зависит от природы структурных переходов, вызванных присоединением первой молекулы субстрата.
Какая из моделей правильна? Для одних аллостерических белков хорошо подходит модель согласованного механизма, тогда как для других, по-видимому, применима модель последовательного механизма. Однако существует группа аллостерических белков, к которым неприменимы обе модели. Предполагается, что эти белки имеют не два (R и Т), а более конформационных состояния. Соответственно для описания аллостерических свойств таких белков требуются более сложные модели.
6.19. Водородные связи, а также электростатические и вандерваальсовы взаимодействия в фермент-субстратных комплексах
Обратимые молекулярные взаимодействия в биологических системах опосредуются силами трех типов. Складывание макромолекул в сложную структуру, связывание субстрата с ферментом, межклеточные взаимодействия, т. е. все молекулярные взаимодействия в биологических системах, осуществляются благодаря образованию водородных связей, а также связей, обусловленных электростатическими и вандерваальсовыми взаимодействиями. Эти три основных типа нековалентных связей различаются по своей геометрии, энергии и специфичности. Более того, хотя на них всегда сильно влияет присутствие воды, однако этот эффект проявляется по-разному. Рассмотрим подробнее каждый из этих основных типов связей.
6.20. Заряженные субстраты могут связываться с противоположно заряженными группами фермента
Заряженная группа субстрата может реагировать с группой фермента, несущей противоположный заряд. Сила такого электростатического взаимодействия определяется законом Кулона:
![]()
где q1 и q2 - заряды соответствующих групп, r-расстояние между ними, D- диэлектрическая постоянная среды. Электростатическое взаимодействие наиболее сильно проявляется в вакууме (где D= 1) и наиболее слабо-в такой среде, как вода (где D = 80).
Примером электростатического взаимодействия может служить связывание глицил-L-тирозина с карбоксипептидазой А- протеолитическим ферментом, который отщепляет С-концевые остатки аминокислот. Отрицательно заряженная концевая карбоксильная группа дипептидного субстрата взаимодействует с положительно заряженной гуанидиниевой группой аргининового остатка на ферменте. Расстояние между этими двумя противоположно заряженными группами составляет 2,8 А:
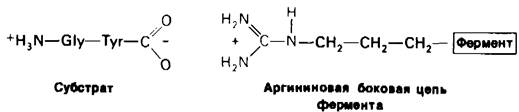
Такой тип взаимодействия называют также ионной связью, солевой связью, солевым мостиком или ионной парой. Все эти термины имеют одно и то же значение: электростатическое взаимодействие между противоположно заряженными группами. Между отрицательно заряженным субстратом и положительно заряженной боковой цепью лизинового или аргининового остатка могут возникать электростатические взаимодействия. Если величины рК имидазольной группы остатка гистидина или концевой аминогруппы полипептидной цепи обеспечивают их положительный заряд при данном pH среды, то они также могут функционировать как потенциальные участки связывания отрицательно заряженного субстрата. В случае если субстрат имеет положительный заряд, потенциальными участками связывания служат отрицательно заряженные карбоксильные группы аспартата и глутамата, а также концевая карбоксильная группа полипептидной цепи.