БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 2. ОСНОВНЫЕ ПРЕДСТАВЛЕНИЯ О СТРУКТУРЕ И ФУНКЦИИ БЕЛКОВ
2.2. Особые аминокислоты дополняют основной набор, насчитывающий двадцать аминокислот
В ряде белков содержатся особые аминокислоты, образующиеся путем модификации обычных аминокислот после их включения в полипептидную цепь. Так, например, в состав коллагена входит гидроксипролин-гидроксилированное производное пролина (рис. 2.16). Как будет показано далее (разд. 9.7), дополнительная гидроксильная группа стабилизирует структуру коллагенового волокна. Биологическое значение этой модификации аминокислоты становится очевидным при цинге, развивающейся в результате недостаточного гидроксилирования коллагена. Еще одна модифицированная кислота - γ-карбоксиглутамат. Нарушение карбоксилирования глутамата в протромбине-белке свертывающей системы крови может привести к кровоточивости (разд. 8.23). Из обнаруженных в белках модифицированных аминокислот чаще всего встречается фосфосерин. Действие ряда гормонов опосредуется процессами фосфорилирования или дефосфорилирования специфических остатков серина в различных белках (разд. 16.11).
Рис. 2.16. Ряд модифицированных аминокислотных остатков, содержащихся в белках: гидрокси- пролин, γ-карбоксиглутамат и фосфосерин. Красным показаны группы, которые присоединяются к аминокислотному остатку после его включения в полипептидную цепь
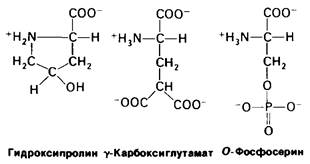
Таблица 2.1. Сокращенные обозначения аминокислот
