БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 8. АКТИВАЦИЯ ПРОФЕРМЕНТОВ: ПИЩЕВАРИТЕЛЬНЫЕ ФЕРМЕНТЫ И ФАКТОРЫ СВЕРТЫВАНИЯ КРОВИ
8.2. Трехмерная структура химотрипсина
Понять суть этого удивительного процесса активации можно, лишь зная в деталях структуру и механизм каталитического действия химотрипсина. К счастью, фермент этот исследован достаточно хорошо методами химического и рентгеноструктурного анализа. По существу, химотрипсин-это один из самых изученных ферментов, и поэтому имеет смысл рассмотреть его более детально.
Молекула химотрипсина состоит из трех полипептидных цепей, соединенных двумя межцепочечными дисульфидными связями (рис. 8.4). Масса фермента составляет около25 кДа. Трехмерную структуру фермента при разрешении 2 А (рис. 8.5) установили Дэвид Блоу (D. Blow) и сотрудники методом рентгеноструктурной кристаллографии.
Рис. 8.4. В молекуле α-химотрипсина имеются два межцепочечных дисульфидных мостика и три внутрицепочечные дисульфидные связи
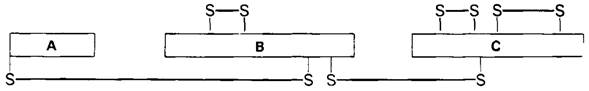
Рис. 8.5. Трехмерная структура α-химотрипсина. Показаны только α- углеродные атомы. Цветом отмечены участвующие в катализе остатки
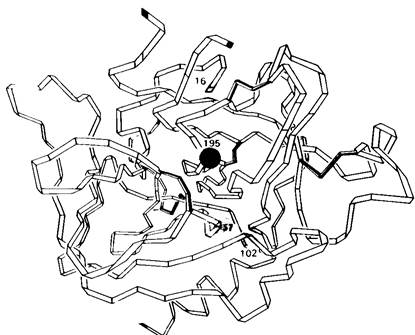
Молекула химотрипсина имеет компактную эллипсоидную форму размером 51 х 40 х 40 А. Все заряженные группы, за исключением трех, абсолютно необходимых для катализа, находятся на поверхности молекулы. Молекула свернута очень сложно; в отличие от миоглобина и гемоглобина она содержит очень мало α-спиралей. Полипептидные цепи в основном вытянуты и нередко идут параллельными тяжами на расстоянии друг от друга примерно 5 А. Между пептидными группами в прилегающих тяжах образуются многочисленные водородные связи. Часть молекулы обладает вторичной структурой, напоминающей антипараллельные складчатые слои, как это наблюдалось и в лизоциме.
8.3. Химотрипсин специфичен в отношении ароматических и больших неполярных боковых цепей
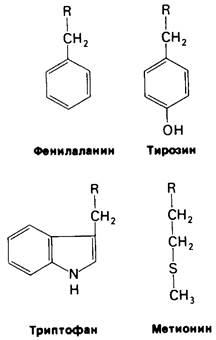
Биологическая роль химотрипсина-гидролизовать белки в тонком кишечнике (рис. 8.6). Равновесие этой реакции сдвинуто почти полностью в сторону гидролиза (> 99%). Однако химотрипсин способен гидролизовать с высокой скоростью далеко не всякую пептидную связь. Он действует избирательно на пептидные связи, образованные карбоксильными группами аминокислот с ароматическими боковыми цепями- тирозина, триптофана и фенилаланина, а также аминокислот с гидрофобными остатками большого размера, например, метионина (рис. 8.7).
Рис. 8.6. Химотрипсин катализирует гидролиз пептидных и эфирных связей
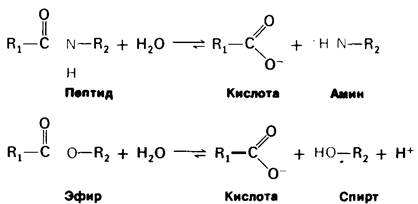
Химотрипсин гидролизует также эфирные связи. Хотя эта реакция не имеет существенного физиологического значения, она представляет интерес в том отношении, что имеет много общего с гидролизом пептидной связи (рис. 8.6). По существу, значительная часть сведений о механизме каталитического действия химотрипсина была получена при изучении гидролиза простых эфиров.
Рис. 8.7. Химотрипсин гидролизует предпочтительно пептидные связи, образованные карбоксильными группами ароматических аминокислот, а также аминокислот с большой неполярной боковой цепью
8.4. При катализе химотрипсином часть субстрата ковалентно связывается с ферментом
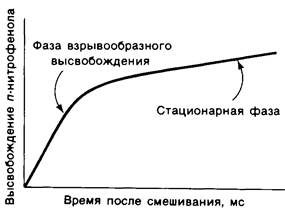
Химотрипсин катализирует гидролиз пептидных и эфирных связей в два отдельных этапа. Впервые это было обнаружено при изучении кинетики гидролиза n- нитрифенилацетата. При использовании больших количеств фермента можно отчетливо проследить наличие двух фаз в высвобождении одного из продуктов реакции -n- нитрофенола (рис. 8.8). Сначала наблюдается быстрое взрывообразное высвобождение n-нитрофенола, после чего он образуется уже с меньшей стационарной скоростью.
Рис. 8.8. После смешивания химотрипсина и n-нитрофенилацетата можно наблюдать две фазы образования n-нитрофенола
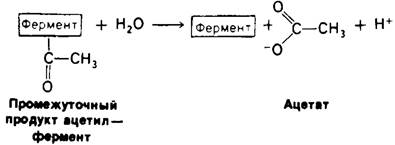
На первом этапе n-нитрофенилацетат присоединяется к химотрипсину, т. е. образуется фермент-субстратный (ЕS) комплекс (рис. 8.9). Эфирная связь в субстрате при этом расщепляется. Один из продуктов реакции - n-нитрофенол - высвобождается, тогда как ацетильная группа субстрата становится ковалентно связанной с ферментом. Далее вода атакует ацетил-ферментный комплекс с образованием ацетат-иона и регенерированного фермента (рис. 8.10). Начальная быстрая фаза высвобождения n-нитрофенола соответствует этапу образования ацетил-ферментного комплекса. Этот этап называется ацилированием. Более медленное стационарное образование n-нитрофенола соответствует этапу гидролиза ацетил-ферментного комплекса и регенерации свободного фермента. Этот второй этап, называемый деацилированием, лимитирует скорость всего процесса гидролиза эфиров химотрипсином. Более того, ацетил-ферментный комплекс настолько стабилен, что при благоприятных условиях его удается выделить. Механизм катализа химотрипсином можно представить в виде следующей схемы:
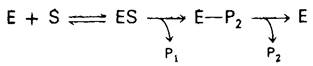
где Р1-аминный (или спиртовой) компонент субстрата, Е-Р2-промежуточный продукт, образованный в результате ковалентного связывания, Р2-кислотный компонент субстрата.
Рис. 8.9. Ацилирование: образование комплекса ацетил - фермент в качестве промежуточного продукта
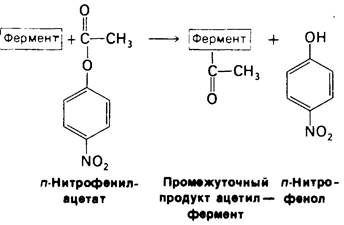
Рис. 8.10. Деацилирование: гидролиз промежуточно образующегося комплекса ацетил-фермент
Особенность этого механизма реакции состоит в образовании промежуточного продукта путем ковалентного связывания; в рассмотренном выше случае происходило ковалентное соединение ацетильной группы с ферментом. В общем случае группа, присоединенная к химотрипсину на стадии Е-Р2,-это всегда ацильная группа. Таким образом, Е2-Р представляет собой промежуточное соединение ацил-фермент.