БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 8. АКТИВАЦИЯ ПРОФЕРМЕНТОВ: ПИЩЕВАРИТЕЛЬНЫЕ ФЕРМЕНТЫ И ФАКТОРЫ СВЕРТЫВАНИЯ КРОВИ
8.5. Ацильная группа соединяется с необычайно реакционноспособным остатком серина на ферменте
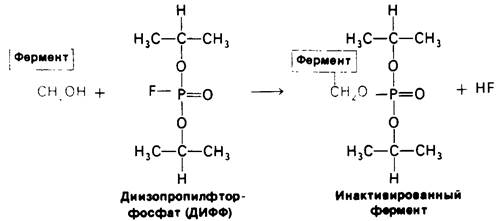
Место, в котором происходит присоединение ацильной группы к ферменту, удалось определить, когда был выделен в чистом виде промежуточный продукт Е-Р2, стабильный при pH 3. Оказалось, что ацильная группа присоединяется к атому кислорода специфического остатка серина, а именно серина-195. Этот остаток серина проявляет необычно высокую реакционную способность. Его можно специфически пометить каким-либо органическим фторфосфатом, например, диизопропилфторфосфатом (ДИФФ), который взаимодействует только с серином-195, давая неактивный высокостабильный комплекс диизопропилфосфорил - фермент (рис. 8.11). О повышенной реакционной способности серина-195 отчетливо свидетельствует тот факт, что остальные 27 остатков серина в химотрипсине не взаимодействуют с ДИФФ.
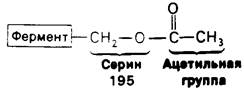
Рис. 8.11. Диизопропилфторфосфат (ДИФФ) инактивирует химотрипсин путем образования диизопропилфосфорильного производного серина-195
Химотрипсин - не единственный фермент, инактивирующийся в присутствии ДИФФ. Множество других протеолитических ферментов, например, трипсин, эластаза, тромбин, субтилизин, специфически реагируют с ДИФФ, полностью теряя при этом активность. Как и в случае химотрипсина, реакция этих ферментов с ДИФФ идет только по одному остатку серина. Отсюда и их общее название -сериновые протеиназы. ДИФФ вступает также в реакцию с остатком серина в ацетилхолинэстеразе - ферменте, играющем ключевую роль в передаче нервных импульсов в определенных синапсах. Как уже упоминалось в гл. 6, способность ДИФФ инактивировать ацетилхолинэстеразу лежит в основе его использования в инсектицидах и нервнопаралитических газах.
8.6. Участие гистидина-57 в катализе выявляется с помощью аффинной метки
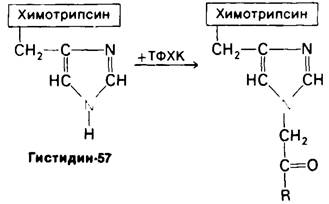
Участие в катализе второго аминокислотного остатка было установлено путем использования так называемой аффинной метки, или метки по сродству. Метод заключается в том, что к химотрипсину добавляют вещество, которое 1) специфически связывается в активном центре в силу подобия с субстратом и затем 2) образует стабильную ковалентную связь с некоторой группой, расположенной на ферменте поблизости. Таким веществом является тозил-L-фенилаланинхлорметилкетон (ТФХК), строение которого показано на рис. 8.12. Наличие боковой цепи фенилаланина в ТФХК обеспечивает его специфическое связывание с химотрипсином. Реактивная группа ТФХК-это хлорметилкетон. ТФХК атакует химотрипсин только по гистидину-57, алкилируя один из атомов азота гистидинового кольца (рис. 8.13). ТФХК- производное химотрипсина лишено ферментативной активности. Имеется три довода в пользу присутствия гистидина-57 в активном центре фермента. Во-первых, аффинная метка в высокой степени стереоспецифична: D-изомер ТФХК абсолютно неэффективен. Во-вторых, присутствие конкурентного ингибитора трипсина - Р-фенил- пропионата - тормозит реакцию с ТФХК. В-третьих, скорость инактивации химотрипсина при добавлении ТФХК находится примерно в такой же зависимости от pH, как скорость катализа.
Рис. 8.12. Структура тозил-L-фенилаланинхлорметилкетона (ТФХК), используемого в качестве аффинной метки химотрипсина R-тозильная группа)
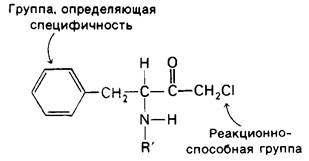
Рис. 8.13. Алкилирование гистидина-57 в химотрипсине воздействием ТФХК
8.7. Система переноса заряда обеспечивает челночную передачу протона при катализе
Каталитическая активность химотрипсина определяется необычайно высокой реакционноспособностью серина-195. В физиологических условиях —СН2ОН-группа
обычно инертна. Почему же в активном центре химотрипсина ее реакционная способность столь резко возрастает? Объяснить это можно, исходя из результатов рентгеноструктурного исследования трехмерной структуры фермента. Как и можно было предположить еще на основе результатов введения аффинной метки, гистидин-57 расположен в непосредственной близости от серина-195. Рядом находится также карбоксильная группа боковой цепи аспартата-102 (рис. 8.14).
Рис. 8.14. Конформация системы переноса заряда в химотрипсине
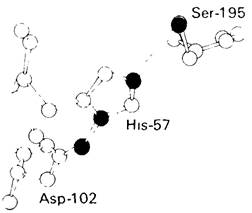
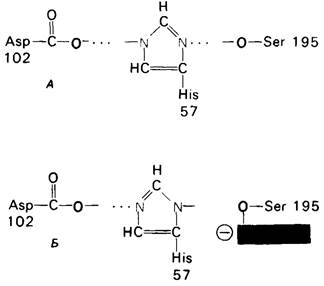
По существу, каталитическая способность химотрипсина обусловлена взаимодействием этих трех остатков. Аспартат-102 образует водородную связь с гистидином-57, который в свою очередь соединен водородной связью с серином-195. Эти три остатка создают систему переноса заряда. Как показано в разд. 8.9, эта система играет ключевую роль в катализе благодаря способности связывать протон (рис. 8.15). Погруженный в молекулу карбоксилатион аспартата-102 поляризует имидазольную группу гистидина-57, что повышает его способность осуществлять челночную передачу протона. При этом аспартат-102 и гистидин-57 расположены так, что во время нуклеофильной атаки субстрата кислородом они акцептируют протон гидроксильной группы серина-195.
Рис. 8.15. Система переноса заряда в химотрипсине: А - фермент без субстрата; Б-при добавлении субстрата происходит промежуточное связывание протона аспартатом-102 и гистидином-57