БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 8. АКТИВАЦИЯ ПРОФЕРМЕНТОВ: ПИЩЕВАРИТЕЛЬНЫЕ ФЕРМЕНТЫ И ФАКТОРЫ СВЕРТЫВАНИЯ КРОВИ
8.8. В химотрипсине имеется глубокий карман для связывания ароматической боковой цепи
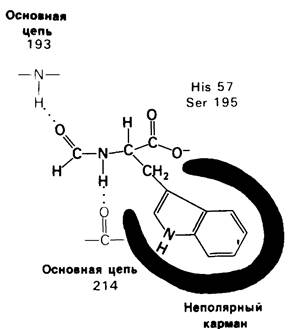
Локализация участков специфического связывания и вероятная ориентация гидролизуемой пептидной связи эффективного субстрата были выявлены в результате рентгеноструктурного анализа комплексов химотрипсина с аналогами субстрата. Установлено, что формил-L-триптофан связывается с химотрипсином через индольную боковую цепь, которая хорошо соответствует по размеру карману на ферменте вблизи серина-195 (рис. 8.16). Именно наличием этого глубокого кармана объясняется специфичность химотрипсина в отношении аминокислот с ароматической или иной гидрофобной боковой цепью большого размера. При рентгеноструктурном анализе комплексов химотрипсина с аналогами полипептидных субстратов обнаружено большое число водородных связей между основными цепями фермента и субстрата, причем эти водородные связи располагаются так же, как в антипаралдельных β-складчатых слоях.
Рис. 8.16. Схематическое изображение присоединения к химотрипсину формил-L-триптофана (аналог субстрата)
8.9. В процессе катализа образуется переходное тетраэдрическое промежуточное соединение
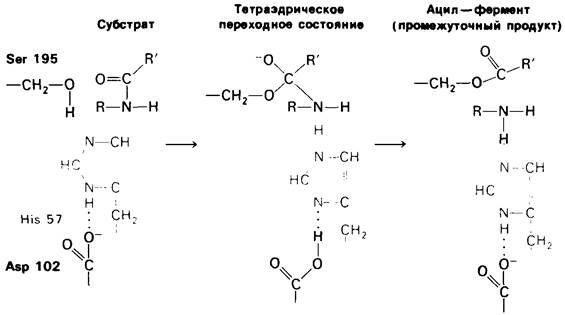
Широкие рентгеноструктурные и химические исследования химотрипсина позволили прийти к определенному выводу относительно механизма его каталитического действия. По-видимому, гистидин-57 и серин-195 непосредственно участвуют в расщеплении пептидной связи субстрата. Гидролиз этой связи начинается с того, что кислородный атом ОН-группы серина-195 атакует карбонильный атом углерода в гидролизуемой пептидной связи субстрата. В результате связь между атомами углерода и кислорода в этой карбонильной группе становится одинарной и атом кислорода приобретает отрицательный заряд. Четыре атома, связанные с углеродом карбонильной группы, располагаются в виде тетраэдра. Образование из плоской амидной группы этого тетраэдрического промежуточного соединения оказывается возможным только благодаря возникновению водородных связей между отрицательно заряженным атомом кислорода гидроксильной группы (называемым оксианионом) и двумя NН-группами самой полипептидной цепи (рис. 8.17). В механизме образования упомянутого промежуточного соединения важную роль играет также перенос протона от серина-195 на гистидин-57 (рис. 8.18). Перенос протона значительно облегчается благодаря присутствию системы переноса заряда. Аспартат-102 строго ориентирует положение имидазольного кольца гистидина-57 и частично нейтрализует заряд, появляющийся на этом кольце в момент переходного состояния. Протон, накопленный парой гистидин - аспартат, переходит далее к атому азота гидролизуемой пептидной связи, которая в результате разрывается. На этом этапе аминный компонент субстрата оказывается соединенным водородной связью с гистидином-57, а кислотный компонент-эфирной связью с серином-195. На этом завершается стадия ацилирования гидролитической реакции.
Рис. 8.17. Тетраэдрическое промежуточное соединение в реакциях ацилирования и деацилирования химотрипсина. Стабильность промежуточного соединения обеспечивают водородные связи, образованные NН-группами основной цепи фермента. Этот участок называется полостью оксианиона
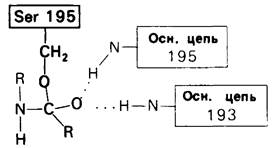
Рис. 8.18. Первый этап гидролиза пептидов химотрипсином - ацилирование. Образуется тетраэдрическое промежуточное соединение. Затем аминный компонент субстрата быстро отделяется от фермента, а фермент превращается в ацил— фермент - промежуточный продукт катализа
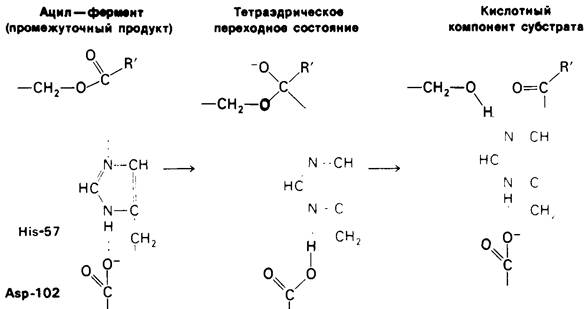
Следующая стадия - деацилирование (рис. 8.19). Аминный компонент субстрата диффундирует прочь от фермента, а на его место в активном центре встает молекула
воды. По сути деацилирование - это процесс, обратный ацилированию, но с заменой аминного компонента субстрата на Н2O. Сначала система переноса заряда отрывает протон от воды. Образующийся ОН--ион немедленно атакует карбонильный атом углерода ацильной группы, присоединенной к серину-195. Как и при ацилировании, формируется тетраэдрическое промежуточное соединение. Далее гистидин-57 передает протон на атом кислорода серина-195, что приводит к высвобождению кислотного компонента субстрата. Этот компонент отделяется путем диффузии от фермента, который может вступить в новый каталитический цикл.
Рис. 8.19. Второй этап гидролиза пептида химотрипсином-дефилирование. Ацил—фермент (промежуточный продукт) гидролизуется водой. Деацилирование по существу представляет собой реакцию, обратную ацилированию, но на место аминного компонента субстрата становится Н2O
8.10. Механизм активации профермента
Обратимся теперь к вопросу о том, каким образом расщепление всего одной пептидной связи в химотрипсиногене превращает его в активный фермент. Трехмерную структуру химотрипсиногема исследовал Джозеф Краут (J. Kraut), установивший, что в процессе активации фермента его конформация притерпевает ряд изменений.
1. Гидролиз пептидной связи между аргинином-15 и изолейцином-16 создает новые С- и N--концевые группы.
2. Вновь образованная N-концевая группа изолейцина-16 загибается внутрь и взаимодействует с аспартатом-194 внутри молекулы химотрипсина (рис. 8.20).
Протонирование этой аминогруппы стабилизирует активную форму химотрипсина, о чем свидетельствует характер зависимости ферментативной активности от pH.
Рис. 8.20. Окружение аспартата-194 и изолейцина-16 в химотрипсине. Электростатическое взаимодействие между карбоксилат-ионом Asp-194 (красный) и α-NН2-группой Ile-16 (синяя) играет важную роль в каталитической активности химотрипсина. Эти группы расположены в непосредственной близости к системе переноса заряда
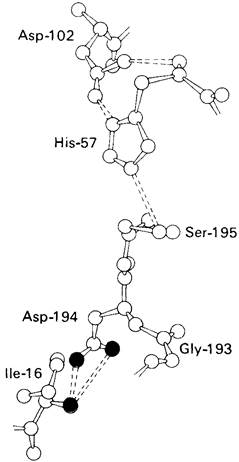
3. Это электростатическое взаимодействие между положительно заряженной аминогруппой и отрицательно заряженным карбоксилат-ионом, происходящее в неполярной области фермента, запускает ряд конформационных сдвигов. Метионин-192 из глубины молекулы перемещается ближе к поверхности, а остатки 187 и 193 становятся более вытянутыми. В результате образуется субстрат-специфичный участок для ароматических и больших неполярных групп. Одну сторону этого участка составляют остатки от 189 до 192. В проферменте эта полость для связывания части субстрата сформирована не полностью.
4. Тетраэдрическое переходное состояние, возникающее при катализе химотрипсином, стабилизируется водородными связями между отрицательно заряженным атомом кислорода карбоксильной группы и двумя NН-группами самой полипептидной цепи (рис. 8.17). В химотрипсиногене одна из этих NН-групп расположена так, что недоступна для связывания. Следовательно, в зимогене и полость оксианиона до конца не сформирована.
5. Конформационные сдвиги в остальных частях молекулы очень незначительны. Таким образом, «включение» ферментативной активности в белке осуществляется путем отдельных, строго локализованных конформационных сдвигов, запускаемых гидролизом всего лишь одной пептидной связи.