БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 9. БЕЛКИ СОЕДИНИТЕЛЬНОЙ ТКАНИ: КОЛЛАГЕН, ЭЛАСТИН И ПРОТЕОГЛИКАНЫ
Все многоклеточные организмы содержат коллаген, представляющий собой семейство фибриллярных белков. Особенно много коллагена у млекопитающих, где на его долю приходится четвертая часть всех белков. Коллаген является основным фибриллярным элементом кожи, костей, сухожилий, хряща, кровеносных сосудов, зубов. В этом или ином количестве он содержится почти во всех органах, и именно он объединяет клетки в определенные структурные единицы. Помимо этой «структурной» роли в сформировавшихся тканях коллаген играет организующую роль в развивающихся тканях. Отличительным свойством коллагена является его способность к формированию нерастворимых фибрилл, обладающих высокой упругостью (рис. 9.1). Более того, структура коллагеновых волокон зависит от типа ткани и соответствует ее специализации. Охарактеризованы четыре типа коллагена (табл. 9.1).
Коллаген-слово происходит от греческого выражения «производить клей».
Рис. 9.1. Электронная микрофотография интактных коллагеновых волокон кожи. Препарат напылен хромом. Периодичность структуры по оси волокна составляет 640 А

Таблица 9.1. Типы коллагена
9.1. Тропоколлаген как основная структурная единица коллагена
Нерастворимость коллагена на протяжении многих лет служила препятствием для изучения его химических свойств. Положение изменилось лишь после того, как обнаружилось, что коллаген из тканей молодых животных можно экстрагировать в растворимом виде, поскольку на этом этапе в нем относительно мало поперечных связей. Отсутствие ковалентных поперечных связей в незрелом коллагене позволяет выделить основную структурную единицу, названную тропоколлагеном.
Молекулярная масса тропоколлагена составляет около 285 кДа; он состоит из трех полипептидных цепей одинакового размера. Состав цепей зависит от типа коллагена (табл. 9.1. Коллаген типа I, содержащийся в организме в наибольшем количестве, состоит из двух цепей одного тина, обозначаемых α1 (I), и третьей цепи, обозначаемой а.2. Коллагены других типов состоят из трех идентичных цепей. Каждая из трех нитей коллагена включает около 1000 аминокислотных остатков. Таким образом, основная структурная единица коллагена имеет очень большие размеры, в частности она более чем в 10 раз больше химотрипсина.
9.2. Коллаген обладает необычным составом и необычной последовательностью аминокислот
В молекуле коллагена примерно 1/3 аминокислотных остатков приходится на глицин, что необычайно много для белков. В гемоглобине, например, содержание глицина составляет только 5% общего содержания Чаминокислот. Количество пролина в коллагене также значительно выше, чем в большинстве других белков. Наконец, в коллагене имеются две аминокислоты, крайне редко встречающиеся в других белках, а именно гидроксипролин и гидроксилизин:
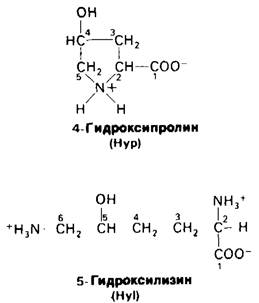
Последовательности аминокислотных остатков в коллагене свойственна высокая степень регулярности: почти каждый третий остаток-это глицин; часто повторяются участки глицин-пролин-гидроксипролин (рис. 9.2). В этом отношении коллаген отличается от глобулярных белков, которым несвойственна регулярность последовательности аминокислот; помимо коллагена этим свойством обладают фиброин шелка и эластин.
Рис. 9.2. Последовательность аминокислот в части цепи α1 (I) коллагена. На протяжении более чем 1000 остатков каждым третьим остатком является глицин