БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 9. БЕЛКИ СОЕДИНИТЕЛЬНОЙ ТКАНИ: КОЛЛАГЕН, ЭЛАСТИН И ПРОТЕОГЛИКАНЫ
9.3. Некоторые остатки пролина и лизина в коллагене гидроксилируются
Гидроксипролин и гидроксилизин не включаются в состав полипептидной цепи коллагена в процессе синтеза белка. Если ввести крысе 14С-гидроксипролин, то в новосинтезированном коллагене радиоактивности не обнаружится. Однако при введении 14С-пролина гидроксипролин в коллагене окажется радиоактивным. Следовательно, пролин, но не экзогенный гидроксипролин служит предшественником гидроксипроли- новых остатков в коллагене.
Определенные остатки пролина в коллагене превращаются в гидроксипролин под действием пролилгидроксилазы - фермента» содержащего в активном центре атом железа (в ферроформе). Дойором атома кислорода, присоединяющегося к С-4 пролина, служит О2. Второй атом кислорода из молекулы О2 включается в сукцинат, образующийся из второго обязательного субстрата этой реакции - α-оксоглутарата (рис. 9.3). Таким образом, пролилгидроксилаза является диоксигеназой. Примечательная особенность этой реакции гидроксилирования состоит в том, что для ее осуществления необходим восстановительный агент, а именно аскорбиновая кислота (разд. 9.8), благодаря которой сохраняется ферроформа атома железа.
Рис. 9.3. Гидроксилирование остатка пролина по С-4 под действием пролилгидроксилазы - фермента, активирующего молекулярный кислород
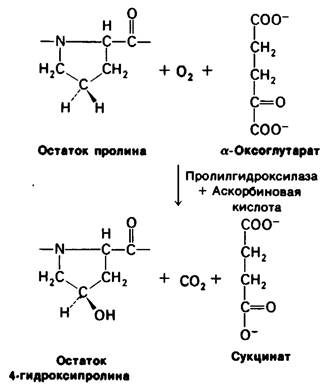
Рассматриваемая реакция гидроксилирования высокоспецифична. Свободный пролин не может служить субстратом реакции. Гидроксилированию подвергаются специфические участки довольно большой, но еще не спирализованной полипептидной цепи. Гидроксилированию по С-4 подвергаются только те остатки пролина, которые расположены со стороны аминогруппы глицинового остатка. Помимо этого, несколько остатков пролина гидроксилируется по С-3 другими ферментными системами, причем эти пролины всегда расположены с карбоксильной стороны глициновых остатков.
Под действием лизилгидроксилазы происходит гидроксилирование по С-5 небольшой части остатков лизина в коллагене. Как и при гидроксилировании пролина, в процессе участвуют молекулярный кислород, α-оксоглутарат и аскорбиновая кислота. Подвергающиеся гидроксилированию остатки лизина всегда расположены со стороны аминогруппы остатков глицина.
9.4. К остаткам гидроксилизина присоединены сахара
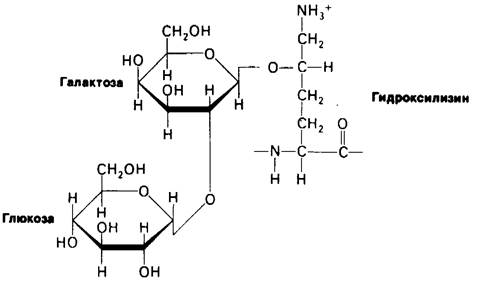
В коллагене содержатся углеводные единицы, ковалентно связанные с остатками гидроксилизина. Чаще всего это дисахарид глюкозы и галактозы (рис. 9.4). Присоединение сахаров происходит в результате последовательного действия галактозил-трансферазы и глюкозилтрансферазы. Эти ферменты гликозилирования специфичны в отношении остатков гидроксилизина в новосинтезированном коллагене, еще не претерпевшем спирализации. Число углеводных единиц в тропоколлагене зависит от вида ткани. Так, например, в коллагене сухожилий (тип I) это число равно 6, а в коллагене капсулы хрусталика (тип IV)-110.
Рис. 9.4. Углеводные компоненты коллагена
9.5. Структура тропоколлагена - это тройной спирально скрученный тяж
Обратимся к конформации основной структурной единицы коллагенового волокна типа I.
Как показали электронно-микроскопические и гидродинамические исследования, тропоколлаген имеет форму стержня длиной 3000 А и диаметром 15 А. Это один из самых длинных среди известных белков. Для сравнения укажем, что по длине тропоколлаген в 60 раз больше диаметра химотрипсина, а по диаметру - в 2 с лишним раза меньше. Каждая из трех полипептидных цепей имеет форму спирали (рис. 9.5). Кроме того, эти три спирализованные цепи закручиваются относительно друг друга, образуя тугую нить. И действительно, коллагеновое волокно обладает удивительной прочностью: для разрыва волокна диаметром 1 мм нужна сила в 10 кг.
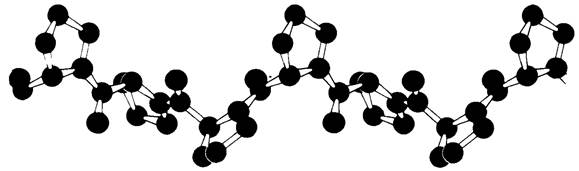
Характер спирализации каждой из цепей в трехцепочечной нити коллагена хорошо виден на примере модельного соединения - поли-L-пролина. Этот синтетический полипептид имеет спиральную форму (рис. 9.6), совершенно отличную от а-спирали. В нем отсутствуют водородные связи. Вместо них стабилизацию спирали обеспечивают силы стерического отталкивания пирролидоновых колец в остатках пролина. При спирализации полипептидной цепи пирролидоновые кольца располагаются как можно дальше друг от друга, образуя так называемую транс-спираль типа II, структура которой оказывается гораздо более развернутой по сравнению с туго закрученной α-спиралью. Расстояние между двумя аминокислотными остатками по оси спирали поли-L-пролина составляет 3,12 А, тогда как в α-спирали оно равно 1,5 А. На поворот спирали в gоли-L- пролине приходится три аминокислотных остатка.
Рис. 9.5. Модель тройной спирали коллагена. Показаны только α- углеродные атомы
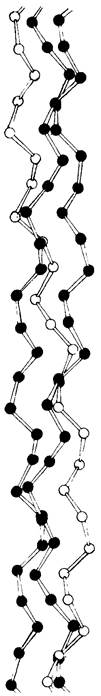
Рис. 9.6. Модель спирали поли-L-пролина (транс-спираль типа II)
Такая же спираль составляет основу пространственной структуры каждой из трех цепей тропоколлагена
Рассмотрим теперь конформацию отдельной цепи в трехцепочечной спирали коллагена (рис. 9.7). Каждая, цепь спирализована аналогично поли-L-пролину. Далее три спирализованные цепи закручиваются одна вокруг другой, образуя суперспираль (рис. 9.8). Расстояние между двумя аминокислотными остатками по оси спирали составляет 2,9 А, а на один виток спирали приходится почти 3,3 остатка. Три цепи связаны между собой водородными связями. Донорами водорода служат пептидные NН-группы остатков глицина, а акцепторами-пептидные СО-группы аминокислотных остатков на других цепях. Водородные связи направлены поперечно к длинной оси тропоколлагенового тяжа. В образовании водородных связей, стабилизирующих тройную спираль, участвуют также гидроксильные группы остатков гидроксипролина и молекулы воды. Пространственная модель тройной спирали коллагена показана на рис. 9.9.
Рис. 9.7. Конформация отдельной цепи в тройной спирали коллагена. Изображен участок цепи с последовательностью -Сlу-Рго- Рго-Glу-Рго-Рго
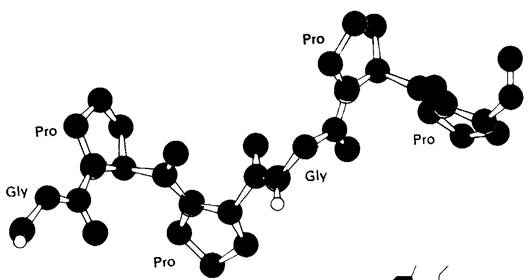
9.8. Скелетная модель тройной спирали коллагена. Показана повторяющаяся последовательность -Gly-Рго-Рго
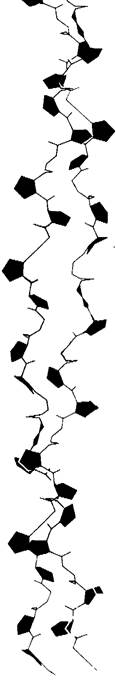
Рис. 9.9. Пространственная модель тройной спирали коллагена
