БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 9. БЕЛКИ СОЕДИНИТЕЛЬНОЙ ТКАНИ: КОЛЛАГЕН, ЭЛАСТИН И ПРОТЕОГЛИКАНЫ
9.6. Малые размеры глицина делают его незаменимым компонентом структуры
Теперь мы можем поставить вопрос: почему каждое третье положение в аминокислотной последовательности тропоколлагена занято глицином? Во внутреннем пространстве тройного спирального волокна очень тесно (рис. 9.10). По существу, кроме глицина ни один аминокислотный остаток не мог бы уместиться внутри тройной спирали. Поскольку на один оборот спирали приходится три аминокислотных остатка, соответственно каждый третий остаток в каждой из цепей неизбежно глицин. Два остатка по обе стороны от глицина оказываются с наружной стороны тройной спирали, где легко размещаются громоздкие кольца остатков пролина и гидроксипролина.
Рис. 9.10. Поперечный срез через модель коллагена. Каждая цепь соединена водородной связью с двумя другими цепями (точки означают водородную связь), α- Углеродный атом остатка глицина в каждой цепи обозначен буквой С. Каждым третьим остатком в последовательностях аминокислот должен быть глицин, так как вблизи оси (центра) спирали не остается места для более крупного остатка. Обратите внимание, что пирролидоновые кольца расположены снаружи. Различные цепи тройной спирали показаны разным цветом
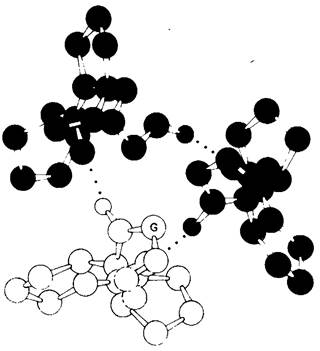
Казалось бы, из всех аминокислот глицин-наименее важная, так как его боковая цепь-это всего лишь один атом водорода. Однако в организации белковой структуры такая простота может оказаться достоинством. Глицин играет очень важную роль именно потому, что он мал и, занимая очень мало места, не препятствует соединению полипептидных цепей друг с другом. Мы уже сталкивались с этим, рассматривая миоглобин и гемоглобин, где глицин инвариантно стоит в положении В6, способствуя сближению спиралей В и Е. В химотрипсине в полости, где происходит связывание субстрата, может уместиться большая ароматическая группа только потому, что два остатка, выстилающие полость, это остатки глицина. В эволюции переносчика электронов цитохрома с самым консервативным аминокислотным остатком оказался глицин. В коллагене мы вновь сталкиваемся с тем, что глицин играет особо важную роль, расширяя диапазон возможных конформаций при скручивании полипептидной цепи.
9.7. Стабильность спирали коллагена зависит от кооперативных взаимодействий
Если раствор тропоколлагена нагреть, то при характеристической температуре происходит изменение его физических свойств (рис. 9.11). Так, резко падает вязкость раствора, что указывает на потерю волокнистой структуры. Судя по изменению оптического вращения, исчезает спиральность структуры отдельных цепей. Отсюда следует, что тепловое движение преодолевает те силы, которые стабилизируют тройную спираль, и в результате возникает разорванная структура-желатин, имеющий конфигурацию статистического клубка. Этот структурный переход возникает дискретно, при определенной температуре, аналогично тому, как происходит плавление кристалла. Перешедший в биохимию термин «плавление» стал применяться в случаях, когда потеря высокоорганизованной структуры происходит в узких температурных пределах. Спираль тропоколлагена характеризуется высокой степенью упорядоченности по длине. Дискретность структурного перехода при повышении температуры указывает на то, что стабилизация тройной спирали обусловлена кооперативными взаимодействиями. Другими словами, спирализация обусловлена образованием множества усиливающих друг друга связей, каждая из которых сама по себе относительно слаба. Образование каждой из этих стабилизирующих связей в большой степени зависит от того, образуются ли одновременно и соседние связи. Примером такой кооперативной структуры может служить застежка-молния. В последующих главах мы рассмотрим ряд других высококооперативных макромолекулярных структур: ДНК, вирусы, клеточные мембраны.
Рис. 9.11. Кривая плавления молекулы коллагена
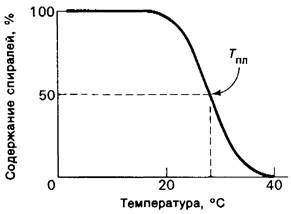
Температура, при которой спирализованность структуры утрачивается наполовину, называется температурой плавления (Тпл). Тпл тропоколлагена служит критерием стабильности его тройной спирали. Для интактных коллагеновых фибрилл сопоставимым показателем является температура сжатия Тсж. Коллагены различных видов организмов различаются по температуре плавления. Оказалось, что Тпл и Тсж коллагенов связаны с температурой тела животного (табл. 9.2), Самой низкой Гпл характеризуются коллагены корюшки, тогда как у теплокровных Тпл достигает наиболее высоких значений. Различия в термостабильности коррелируют с содержанием иминокислот (пролина и гидроксипролина) в коллагене. Чем выше содержание иминокислот, тем стабильнее коллагеновая спираль. Содержание иминокислот в коллагене увеличивалось в процессе эволюции от холоднокровных к теплокровным.
Таблица 9.2. Зависимость термостабильности коллагена от содержания иминокислот

Итак, стабильность спирали отдельной цепи тропоколлагена зависит от пролина и гидроксипролина, действующих в качестве замков. Далее тройная спираль стабилизируется поперечными водородными связями и вандерваальсовыми взаимодействиями между остатками на разных цепях. Наличие глицина в каждом третьем положении последовательности аминокислот служит стерическим разрешением для существования суперспирали.
Определение температуры плавления химически синтезированных полипептидных моделей коллагена пролило свет на биологическое значение процесса гидроксилиро- вания пролина. Так, обнаружилось, что Тпл poly(Pro-Pro-Gly) составляет 24°С, тогда как Тплpoly(Pro-Hyp-Gly) равна 58°С; отсюда следует, что гидроксилирование значительно увеличивает стабильность тройной спирали. Этот вывод подтверждается результатами изучения негидроксилированного коллагена, полученного путем инкубации клеток сухожилия с αα'-бипиридилом соединением, образующим хелатное соединение с железом и потому ингибирующим пролилгидроксилазу. Синтезированный этими клетками негидроксилированный коллаген не образует тройной спирали при 37°С, но быстро спирализуется при температуре ниже 24°С.