БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 9. БЕЛКИ СОЕДИНИТЕЛЬНОЙ ТКАНИ: КОЛЛАГЕН, ЭЛАСТИН И ПРОТЕОГЛИКАНЫ
9.8. Нарушение гидроксилирования - один из биохимических дефектов при цинге
Значение гидроксилирования коллагена со всей очевидностью выступает при цинге. Жак Картье (J. Cartier) в 1536 г. очень живо описал эту болезнь, поразившую его спутников во время путешествия по реке Св. Лаврентия:
«Одни лишились всех своих сил и не могли стоять на ногах... У других к тому же появились на коже багровые пятна крови, которые постепенно покрывали голени, колени, бедра, ягодицы, плечи, руки, шею. Изо рта стал идти зловонный запах, десны так загнили, что отпало все мясо до корней зубов, а сами зубы почти все выпали».
Способы предупреждения цинги были в сжатой форме сформулированы английским врачом Джеймсом Линдом (J. Lind), который писал в 1753 г.:
«Не раз уже убеждались в том, что зелень, свежие овощи и спелые фрукты-не только лучшее лекарство, но и самое действенное средство для предупреждения этой болезни».
Линд настаивал, чтобы в рацион моряков входил лимонный сок. Британское Адмиралтейство прислушалось к его совету примерно через 40 лет.
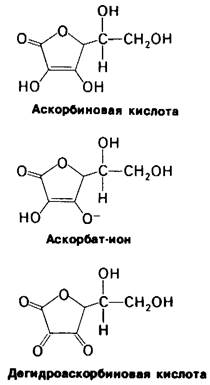
Цинга обусловлена недостаточностью аскорбиновой кислоты (витамина С) в пище. Приматы и морские свинки утратили способность синтезировать аскорбиновую кислоту и поэтому должны получать ее с пищей. Являясь сильным восстановительным агентом, аскорбиновая кислота (рис. 9.12) предохраняет от инактивации пролилгидроксилазу, видимо, поддерживая восстановленное состояние атома железа в ферменте. Коллаген, синтезируемый в отсутствие аскорбиновой кислоты, оказывается недогидроксилированным и, следовательно, имеет пониженную температуру плавления. Такой коллаген не может образовать нормальные по структуре волокна, что и приводит к поражению кожи и ломкости сосудов, столь четко выраженных при цинге.
Рис. 9.12. Формулы аскорбиновой кислоты (витамина С) и ее ионизированной формы - аскорбатиона. рКа кислотных гидроксильных групп аскорбиновой кислоты равно 4,2. Дегидроаскорбиновая кислота является окисленной формой аскорбат-иона
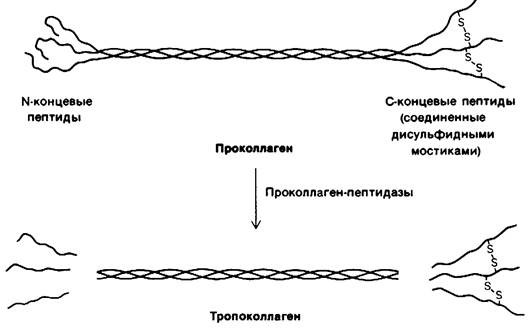
9.9. Проколлаген предшественник коллагена при его биосинтезе
Тройная спираль коллагена типа I in vivo формируется очень быстро. Однако in vitro процесс образования тройной спирали из растворенных цепей α1(I) и α2 длится днями и к тому же имеет низкий выход. Чем же объясняется это различие в сборке тропоколлагеновой спирали in vivo и in vitro? Вспомним для сравнения, как восстанавливается структура денатурированного химотрипсиногена и химотрипсина: денатурированный профермент спонтанно принимает правильную трехмерную конфигурацию, тогда как фермент к этому не способен. Дело в том, что в химотрипсине отсутствует часть структуры, необходимой для возникновения правильной трехмерной конфигурации, а именно два дипептида, которые отщепляются в процессе активации.
По аналогии можно предположить, что неспособность очищенных цепей α1 (I) и α2 к спонтанному образованию правильной тропоколлагеновой структуры обусловлена отсутствием каких-то элементов, несущих необходимую информацию. Так оно и есть на самом деле. Составляющие коллаген цепи синтезируются в виде предшественников большей массы. Предшественник α1 (I)-цепи, называемый про-а.1 (I) имеет массу 140 кДа (тогда как масса α1 (I)-цепи - 95 кДа). Дополнительные пептиды локализуются как на N-, так и на С-конце про-α1 (I)-цепи (рис. 9.13). Подобным же образом предшественником α2-цепи служит про-α2 с массой 140 к Да. По аминокислотному составу дополнительные пептидные участки в про-α1 (I) и про-α2 совершенно не похожи на основную часть цепи. В них мало глицина, пролила и гидроксипролина. N-концевые пептиды в про-α1 (I) и про-α2 содержат внутрицепочечные дисульфидные связи. Более того, С-концевые пептиды этих цепей-предшественников связаны межцепочечными дисульфидными связями, отсутствующими в коллагене.
Рис. 9.13. Схематическое изображение превращения проколлагена в коллаген путем отщепления N-концевого пептида (около 15 к Да) и С-концевого пептида (около 30 кДа) от каждой из трех цепей. В проколлагене С-концевые пептиды трех цепей связаны между собой дисульфидными мостиками