БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ III. БИОСИНТЕЗ ПРЕДШЕСТВЕННИКОВ МАКРОМОЛЕКУЛ
ГЛАВА 21. БИОСИНТЕЗ АМИНОКИСЛОТ И ГЕМА
21.7. S-аденозилметионин - основной донор метильных групп
Тетрагидрофолят может нести метальную группу при N5, однако присущий ему потенциал переноса групп недостаточно высок. В большинстве процессов биосинтеза донором активированной метальной группы служит S-аденозилметионин, с которым мы уже встречались, когда рассматривали превращение фосфатидилэтаноламина в фосфа- тидилхолин (разд. 20.3). S-аденозилметионин синтезируется путем переноса аденозильной группы АТР на атом серы метионина. Метальная группа метионина активируется под действием положительного заряда соседнего атома серы, поэтому ее реакционная способность значительно выше, чем у N5-метилтетрагидрофолята.
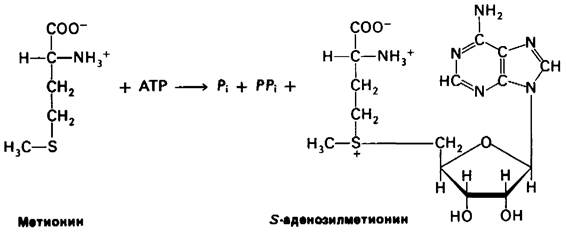
Синтез S-аденозилметионииа необычен в том отношении, что пирофосфатная группа АТР расщепляется на пирофосфат и ортофосфат. Затем пирофосфат гидролизуется. Таким образом, при этой реакции активации все связи фосфор—кислород в АТР расщепляются, что существенно увеличивает реакционную способность метальной группы.
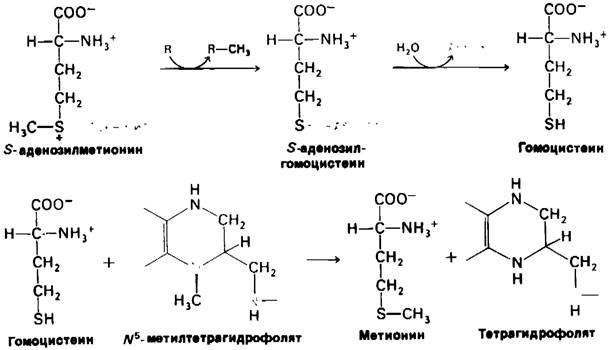
5-аденозилгомоцистеин образуется при переносе метильной группы S-аденозилметионина на какой-нибудь акцептор, например, фосфатидилэтаноламин. Затем S-адено- зилгомоцистеин гидролизуется на гомоцистеин и аденозин.
Метионин может быть регенерирован путем переноса метильной группы N5-метилтетрагидрофолята. Эту реакцию катализирует гомоцистеин-метилтрансфераза.
В этом переносе метильной группы участвует в качестве посредника метилкобаламину кофермент гомоцистеин-метилтрансферазы. Вообще у млекопитающих известна еще только одна реакция, для которой необходим витамин В12, это перестройка L-метилмалонил-СоА в сукцинил-СоА (разд. 18.11). В метилировании гомоцистеина с образованием метионина могут принимать участие и другие доноры, такие, как бетами, продукт окисления холина.
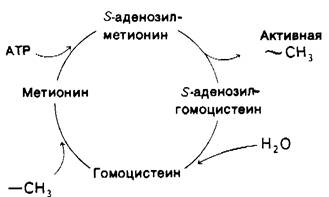
Эти реакции образуют цикл активированной метальной группы (рис. 21.7). Метальные группы вступают в цикл при превращении гомоцистеина в метионин и становятся весьма реакционноспособными в результате расщепления трех высокоэнергетических связей (~ Р). Высокий потенциал переноса метильной группы S-аденозилметионина делает возможным ее перенос на самые разнообразные акцепторы, например, на аминогруппу нейропередатчика норадреналина (разд. 37.11) и на остаток глутаминовой кислоты одного из регуляторных белков хемотаксиса (разд. 37.23).
Рис. 21.7. Цикл активированной метильной группы
21.8. Цистеин синтезируется из серина и гомоцистеина
Кроме того, что гомоцистеин - предшественник метионина в цикле, активированной метильной группы, он является также промежуточным продуктом синтеза цистеина. Серин и гомоцистеин конденсируются с образованием цистатионина (рис. 21.8). Эту реакцию катализирует пиридоксалевый фермент цистатионин-синтетаза. Затем цистатионин дезаминируется и расщепляется на цистеин и α-оксобутират под действием еще одного пиридоксалевого фермента цистатиониназы. Суммарное уравнение этих двух реакций имеет следующий вид:
Гомоцистеин + Серин →Цистеин + α-Оксобутират.
Рис. 21.8. Синтез цистеина
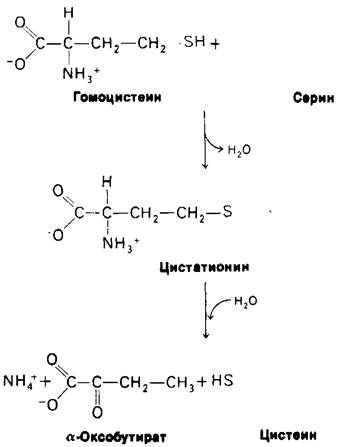
Обратите внимание, что атом серы цистеина происходит из гомоцистеина, тогда как углеродный скелет-из серина.
На этом мы закончим обсуждение биосинтеза заменимых аминокислот. Образование тирозина путем гидроксилирования фенилаланина рассматривалось ранее (разд. 18.16)
21.9. Шикимат и хоризмат- промежуточные продукты биосинтеза ароматических аминокислот
Теперь обратимся к биосинтезу незаменимых аминокислот, пути образования которых гораздо сложнее, чем пути образования заменимых аминокислот. Для обсужде
ния мы выбрали два синтеза - ароматических аминокислот и гистидина.
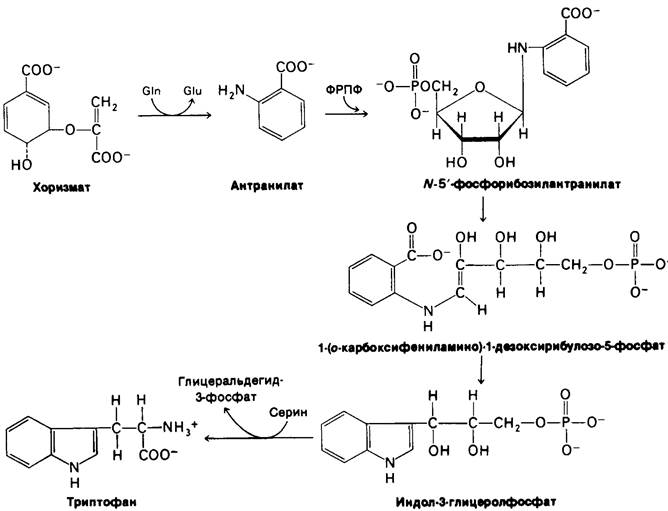
Синтез фенилаланина, тирозина и триптофана у E.coli идет по общему пути (рис. 21.9). Первая стадия - конденсация фосфоенолпирувата (промежуточного продукта гликолиза) с эритрозо-4-фосфатом (промежуточный продукт пентозофосфатното пути). Образующийся семиуглеродный сахар теряет фосфорильную группу и циклизуется с образованием 5-дегидрохинной кислоты. Дегидратация дает 5-дегидрошикимат, который восстанавливается с помощью NADPH до шикимата. Затем еще одна молекула фосфоенолпирувата конденсируется с 5-фосфошикиматом; образовавшийся продукт теряет фосфатную группу и превращается в хоризмат.
Рис. 21.9. Путь биосинтеза ароматических аминокислот у Е. coli
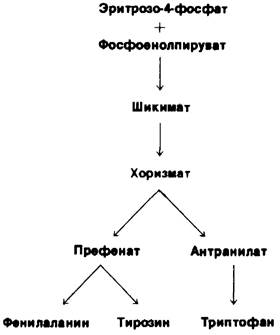
После образования хоризмата путь биосинтеза раздваивается. Проследим вначале ветвь синтеза префената (рис. 21.11).
Рис. 21.11. Синтез тирозина и фенилаланина из хоризмата
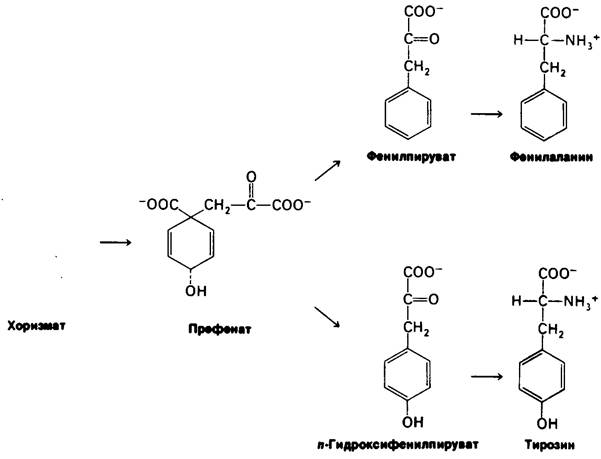
В реакции, катализируемой мутазой, хоризмат превращается в префенат, непосредственный предшественник ароматического кольца фенилаланина и тирозина. В результате реакций дегидратации и декарбоксилирования префената образуется фенилпируват. Кроме того, окислительное декарбоксилирование префената дает n-гидроксифенилпируват. Эти α-оксокислоты подвергаются переаминированию, образуя фенилаланин и тирозин соответственно.
Ветвь, которая начинается с синтеза антранилата, приводит к синтезу триптофана. К хоризмату присоединяется аминогруппа боковой цепи глутамина и образуется антранилаг. Вообще глутамин служит донором аминогрупп во многих реакциях биосинтеза. Затем антранилат конденсируется с фосфорибозилпирофосфатом (ФРПФ), активированной формой рибозофосфата. Кроме того, ФРПФ ключевой промежуточный продукт синтеза гистидина, а также пурин- и пиримидиннуклеотидов (разд. 22.3). Атом С-1 рибозо-5-фосфата связывается с атомом азота антранилага. Движущая сила этой реакции - гидролиз пирофосфата.
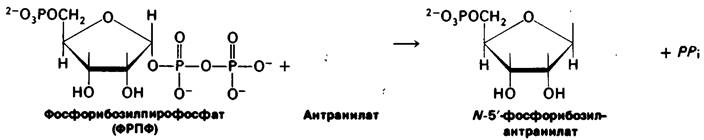
Рибозный остаток фосфориболизантранилата претерпевает перестройку (рис. 21.12) с образованием 1-(О-карбоксифениламино)- 1-дезоксирибулозо-5-фосфата. Этот промежуточный продукт расщепляется и декарбоксилируется с образованием индол-3-гли- церолфосфата. Наконец, индол-3-глицерол- фосфат реагирует с серином, образуя триптофан. Глицерофосфатная боковая цепь индол-3-глицеролфосфата заменяется углеродным скелетом и аминогруппой серина. Эта реакция катализируется триптофан-синтазой.
Рис. 21.12. Синтез триптофана из хоризмата
Триптофан-синтаза Е.соli имеет субъединичное строение α2β2. Фермент можно диссоциировать на две α-субъединицы и комплекс β2. По отдельности они катализируют частичные реакции, приводящие к синтезу триптофана:

Каждый активный участок β2 содержит в качестве простетической группы пиридоксаль- фосфат. При образовании комплекса α2β2 каталитические свойства его компонентов ос и β2заметно меняются. Скорости частичных реакций под действием комплекса α2β2 более чем в 10 раз превышают скорости реакций, катализируемых отдельными субъединицами. Более того, синтез триптофана под действием α2β2 осуществляется с помощью согласованного механизма. Индол, образовавшийся в первой частичной реакции, сразу же реагирует с серином, не высвобождаясь из комплекса с α2β2. Таким образом, взаимодействия между субъединицами мультисубъединичного фермента могут изменять его каталитические свойства.