БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ III. БИОСИНТЕЗ ПРЕДШЕСТВЕННИКОВ МАКРОМОЛЕКУЛ
ГЛАВА 23. ИНТЕГРАЦИЯ МЕТАБОЛИЗМА
23.2. Повторяющиеся мотивы в механизмах регуляции метаболизма
Сложная сеть реакций, протекающих в клетке, тонко регулируется и координируется. Существует несколько способов регуляции метаболических процессов.
Рис. 23.4. Примеры обратимой ковалентной модификации белков: 1 - фосфорилирование; 2-аденилирование; 3- метилирование
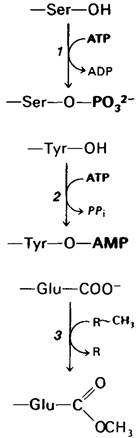
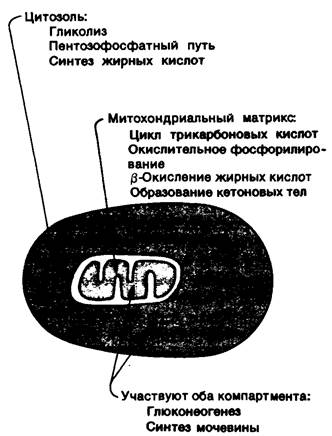
Рис. 23.5. Компартментация основных путей метаболизма
1. Аллостерические взаимодействия. Поток молекул в большинстве метаболических путей определяется прежде всего количеством и активностью определенных ферментов, а не наличием субстрата. Практически необратимые реакции-потенциальные регуляторные участки. Первая необратимая реакция какого-либо метаболического пути (решающий этап) обычно служит важным элементом контроля. Ферменты, катализирующие решающие этапы, регулируются аллостерически, как, например, фосфофруктокиназа при гликолизе или ацетил-СоА — карбоксилаза при синтезе жирных кислот. Кроме того, последующие необратимые реакции того же метаболического пути также могут регулироваться. Аллостерические взаимодействия позволяют таким ферментам распознавать разнообразные сигналы и интегрировать полученную информацию.
2. Ковалентная модификация. Некоторые регуляторные ферменты контролируются не только аллостерически, но и с помощью ковалентной модификации. Например, фосфорилирование повышает каталитическую активность гликоген-фосфорила- зы и снижает активность гликоген-синтазы. Эти ковалентные модификации катализируются особыми ферментами. Еще один пример -глутамин-синтетаза, активность которой снижается при ковалентном присоединении остатка АМР. И в этом случае присоединение и отщепление модифицирующей группы катализируется специальными ферментами. Зачем же используется ковалентная модификация наряду с нековалентной аллостерической регуляцией? Ковалентная модификация ключевых ферментов метаболизма - заключительная стадия каскада реакций, усиливающего сигнал. Благодаря этому метаболический путь может быстро включаться и выключаться под действием очень слабых сигналов, как это показано на примере стимулирующего влияния адреналина на расщепление гликогена.
3. Концентрации ферментов. Количество ферментов, равно как и их активность, регулируется. Скорости синтеза и деградации некоторых регуляторных ферментов регулируются гормональными факторами.
4. Компартментация. Общая картина метаболизма в разных пространственно разграниченных участках (компартментах) эукариотических клеток сильно различается. Гликолиз, пентозофосфатный путь и синтез жирных кислот происходят в цитозоле, а окисление жирных кислот, цикл трикарбоновых кислот и окислительное фосфорилирование - в митохондриях. Некоторые процессы, например, глюконеогенез и синтез мочевины, зависят от взаимодействия реакций, протекающих в обоих компартментах. Судьба некоторых молекул определяется тем, где они находятся - в цитозоле или в митохондриях. Это делает возможным регуляцию их потока через внутреннюю митохондриальную мембрану. Например, жирные кислоты, будучи перенесенными в митохондрии, быстро расщепляются, тогда как в цитоплазме они этерифицируются или выделяются во внеклеточное пространство. Напомним, что жирные кислоты с длинной цепью переносятся внутрь митохондриального матриксa в виде эфиров карнитина - переносчика, благодаря которому эти молекулы оказываются способными проходить сквозь внутреннюю митохондриальную мембрану.
Эффект Пастера - ингибирование гликолиза дыханием, открытое Луи Пастером при исследовании дрожжевого брожения. В аэробных условиях поглощение углеводов примерно в 7 раз ниже, чем в анаэробных. Пастеровский эффект можно объяснить ингибированием фосфофруктокиназы цитратом и АТР.
5. Метаболическая специализация органов. У высших эукариот регуляция более эффективна, поскольку на нее большое влияние оказывает наличие органов со специфической метаболической регуляцией.
23.3. Основные метаболические пути и регуляторные этапы
Рассмотрим роль основных путей метаболизма и важнейшие этапы, на которых осуществляется регуляция
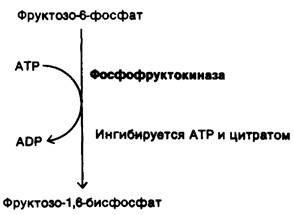
1. Гликолиз. В результате этой последовательности реакций, протекающих в цитозоле, одна молекула глюкозы превращается в две молекулы пирувата. При этом образуются две молекулы АТР и две молекулы NADH. Для того чтобы реакции гликолиза продолжались непрерывно, необходимо регенерировать NAD+, который расходуется в реакции, катализируемой глицеральдегид-3-фосфат—дегидрогеназой. В анаэробных условиях, например, в активно работающей скелетной мышце, это достигается восстановлением пирувата до лактата. В аэробных условиях регенерирование NAD+ осуществляется по-иному-путем переноса электронов от NADH к O2 по цепи переносчиков. Гликолиз выполняет две основные функции: расщепляет глюкозу с образованием АТР и поставляет углеродные скелеты молекул для биосинтетических реакций. Скорость превращения глюкозы в пируват регулируется в соответствии с этими двумя задачами. Важнейший регулируемый этап-фосфофруктоки- наза, катализирующая решающую реакцию гликолиза. Высокая концентрация АТР ингибирует фосфофруктокиназу. Ингибирующее действие АТР усиливается в присутствии цитрата и подавляется АМР. Таким образом, скорость гликолиза определяется потребностью в АТР, о которой сигнализирует соотношение АТР/АМР, и потребностью в строительных блоках, о чем сигнализирует концентрация цитрата.
2. Цикл трикарбоновых кислот. Это заключительный общий путь окисления молекул - источников энергии: углеводов, аминокислот и жирных кислот. Он функционирует в митохондриях. Богатые энергией молекулы вступают в цикл главным образом в виде ацетил-СоА. При полном окислении одного ацетильного остатка образуются одна молекула GTP, три молекулы NADH и одна молекула FADH2. Затем четыре пары электронов переносятся на О2 по цепи переноса электронов; в результате создается градиент концентрации протонов, который обеспечивает синтез одиннадцати молекул АТР. NADH и FADH2 окисляются только в том случае, если ADP одновременно фосфорилируется до АТР. Это тесное сопряжение называется дыхательным контролем; оно обеспечивает соответствие скорости реакций цикла трикарбоновых кислот потребности в АТР. Кроме того, избыток АТР снижает активность трех ферментов цикла-цитрат-синтазы, изоцитрат-дегидрогеназы и α- оксоглутарат-дегидрогеназы. Помимо этого, цикл трикарбоновых кислот играет важную роль в анаболизме. Он обеспечивает синтез некоторых промежуточных продуктов, например, сукцинил-СоА, служащего источником части углеродного скелета пор- фиринов.
3. Пентозофосфатный путь. Этот ряд реакций, протекающих в цитозоле, выполняет две функции: генерирование NADPH для восстановительных реакций биосинтеза и образование рибозо-5-фосфата для синтеза нуклеотидов. Две молекулы NADPH образуются при превращении глюкозо-6- фосфата в рибозо-5-фосфат. Решающий этап данного пути-дегидрирование глюкозо-6-фосфата. Эта реакция регулируется концентрацией акцептора электронов NАDР+. Лишняя фосфорильная группа в NАDРН - ярлычок, отличающий его от NАDН. Благодаря этому различию в одном и том же компартменте может поддерживаться высокое соотношение [NADРН]/[NАDР+] и низкое соотношение [NАDН]/[NАD+]. Следовательно, восстановительные реакции биосинтеза и гликолиз могут протекать одновременно с высокой скоростью.
4. Глюконеогенез. Глюкоза может синтезироваться в печени и почках из предшественников не углеводной природы, таких, как лактат, глицерол и аминокислоты. Различные вещества вступают в реакции этого пути главным образом через пируват, который карбоксилируется в митохондриях с образованием оксалоацатата. Затем оксалоацетат декарбоксилируется и фосфорилируется в цитозоле с образованием фосфоенолпирувата. Еще две гидролитические реакции, характерные для глю- конеогенеза, идут в обход необратимых стадий гликолиза. Глюконеогенез и гликолиз обычно взаимно скоординированы таким образом, что в то время, как один путь бездействует, второй весьма активен. Например, АМР ингибирует, а цитрат активирует фруктозо- 1,6-бисфосфатазу - ключевой фермент глюконеогенеза, тогда как на фосфофруктокиназу, определяющую скорость гликолиза, эти молекулы оказывают обратное действие.
5. Синтез и расщепление гликогена. Гликоген-легко мобилизуемая форма запасания энергии. Он представляет собой разветвленный полимер остатков глюкозы. Активированный промежуточный продукт синтеза гликогена-UDР-глю коза, которая образуется из глюкозо-1-фосфата и UTР. Гликоген-синтаза катализирует перенос глюкозного остатка с UDР-глюкозы на концевую гидроксильную группу растущей цепи. Расщепление гликогена идет другим путем. Фосфорилаза катализирует расщепление гликогена ортофосфатом с образованием глюкозо-1-фосфата. Синтез и расщепление гликогена координируются с помощью усиливающего каскада, запускаемого гормоном, так, что, когда неактивна гликоген-синтаза, активна фосфорилаза, и наоборот. Эти ферменты регулируются посредством фосфорилирования и нековалентных аллостерических взаимодействий (разд. 16.15).
Рис. 23.7. Дегидрирование глюкозо-6- фосфата — решающий этап пентозофосфатного пути
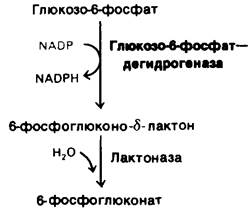
Рис. 23.8. Фруктозо -1,6- бисфосфатаза- ключевой этап регуляции глюконеогенеза
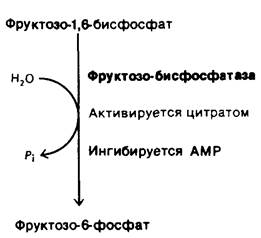
Рис. 23.9. Ацетил-СоА - карбоксилаза - ключевой регуляторный участок синтеза жирных кислот
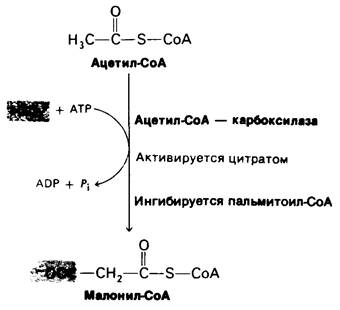
6. Синтез и расщепление жирных кислот. Жирные кислоты синтезируются в цитозоле путем присоединения двухуглеродных остатков к растущей цепи, закрепленной на ацилпереносящем белке. Активированный промежуточный продукт малонил-СоА образуется путем карбоксилирования ацетил-СоА. Ацетильные группы переносятся из митохондрий в цитозоль с помощью цитрата. Этот челночный механизм обеспечивает генерирование части NADPH, необходимого для восстановления присоединенного ацетильного остатка. Остальной NADPH поступает из пентозофосфатного пути. Цитрат стимулирует ацетил-СоА—карбоксилазу, фермент, катализирующий решающий этап. Если в клетке имеется избыток АТР и ацетил-СоА, то концентрация цитрата увеличивается, и это ускоряет синтез жирных кислот. Расщепление жирных кислот происходит другим путем и в другом компартменте. Они расщепляются до ацетил-СоА в митохондриальном матриксе путем β-окисления. Затем, если поступает достаточное количество оксалоацетата, ацетил-СоА вступает в цикл трикарбоновых кислот. В противном случае ацетил-СоА может превращаться в кетоновые тела. FADH2 и NADH, образующиеся в результате β-окисления, отдают свои электроны O2через цепь переноса электронов. Как и цикл трикарбоновых кислот, р-окисление может протекать только при условии постоянного регенерирования NAD+ и FAD. Следовательно, скорость расщепления жирных кислот также связана с потребностью клетки в АТР.