БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ III. БИОСИНТЕЗ ПРЕДШЕСТВЕННИКОВ МАКРОМОЛЕКУЛ
ГЛАВА 23. ИНТЕГРАЦИЯ МЕТАБОЛИЗМА
23.6. Гормональные регуляторы энергетического метаболизма
Гормонам принадлежит ключевая роль в интеграции метаболизма. В частности, инсулин, глюкагон, адреналин и норадреналин оказывают значительное воздействие на запасание и мобилизацию энергетических ресурсов и связанные с этими процессами метаболические превращения.
Рис. 23.17. Электронная микрофотография гранул, содержащих глюкагон, в α-клетках поджелудочной железы
1. Инсулин. Это белковый гормон с мол. массой 5,8 кДа (разд. 2.6 и 35.8). Он секретируется β-кяетками поджелудочной железы и служит важнейшим регулятором энергетического метаболизма. По сути дела, инсулин различными способами сигнализирует о наличии пищевых ресурсов в организме: он стимулирует создание энергетических запасов и синтез белка. Синтез гликогена в мышцах и печени под действием инсулина стимулируется, а глюконеогенез в печени подавляется. Инсулин ускоряет гликолиз в печени, что в свою очередь усиливает синтез жирных кислот. Инсулин способствует поступлению глюкозы в мышцы и жировые клетки. Изобилие жирных кислот и глюкозы в жировой ткани приводит к синтезу и запасанию триацилглицеролов. Действие инсулина распространяется также на метаболизм аминокислот и белков. Инсулин способствует поглощению в мышцах аминокислот с разветвленной цепью (валина, лейцина и изолейцина), что благоприятствует образованию мышечного белка. В целом инсулин оказывает стимулирующее действие на синтез белка. Кроме того, он подавляет внутриклеточный распад белков.
2. Глюкагон. Это полипептидный гормон с мол. массой 3,5 кДа (разд. 16.10). Он секретирустся α-клетками поджелудочной железы в ответ на понижение концентрации сахара в крови. Основной орган-мишень глюкагона-печень. Глюкагон стимулирует расщепление гликогена и ингибирует его синтез, запуская каскад реакций, опосредуемых сАМР. В результате происходит фосфорилирование фосфорилазы и гликоген-синтетазы (разд. 16.15). Кроме того, глюкагон ингибирует синтез жирных кислот, снижая образование пирувата и активность ацетил-СоА—карбоксилазы. К тому же глюкагон стимулирует глюконеогенез. В итоге все эти изменения приводят к заметному снижению выделения глюкозы печенью. Помимо этого, глюкагон повышает содержание циклического АМР в жировых клетках, а это в свою очередь способствует расщеплению триацилглицеролов.
3. Адреналин и норадреналин. Эти гормоны относятся к катехоламинам. Они секретируются мозговым слоем надпочечников и окончаниями симпатических нервов в ответ на снижение концентрации глюкозы в крови. Подобно глюкагону, они стимулируют мобилизацию гликогена и триацилглицеролов, запуская каскад реакций, опосредуемых сАМР. Их отличие от глюкагона состоит в том, что проявляемый ими гликогенолитический эффект более выражен в мышцах, чем в печени. Еще одна функция катехоламинов-ингибировать поглощение глюкозы мышцами. Вместо глюкозы в качестве источника энергии используются жирные кислоты, высвобождающиеся из жировой ткани. Кроме того, адреналин стимулирует выделение глюкагона и подавляет выделение инсулина. Таким образом, катехоламины увеличивают количество глюкозы, выделяемое печенью в кровь, и снижают потребление глюкозы мышцами.
23.7. Печень выполняет роль буфера в регуляции содержания глюкозы в крови
Концентрация глюкозы в норме натощак составляет 80 мг/100 мл (4,4 мМ). В течение дня концентрация глюкозы в крови в норме колеблется от 80 мг/100 мл перед едой до примерно 120 мг/100 мл после еды. Как же поддерживается относительно постоянный уровень содержания глюкозы, несмотря на значительные изменения в ее поступлении и использовании? Выше мы уже обсуждали основные регуляторные элементы, так что теперь мы рассмотрим их во взаимодействии. Содержание глюкозы в крови регулируется прежде всего печенью, которая может поглощать и выделять в кровь большое количество глюкозы в ответ на гормональные сигналы и на само изменение концентрации глюкозы (рис. 23.18). Повышение концентрации глюкозы в крови, происходящее после приема богатой углеводами пищи, в свою очередь вызывает повышение содержания глюкозо-6-фосфата в печени, так, как только в этих условиях каталитические участки глюкокиназы заполняются глюкозой. Напомним, что глюкокиназа в отличие от гексокиназы имеет высокую Км для глюкозы (~ 10 мМ, тогда как концентрация глюкозы в крови натощак составляет 4,4 мМ) и не ингибируется глюкозо-6-фосфатом. В результате при повышении содержания глюкозы в крови скорость образования глюкозо-6-фосфата в печени увеличивается. Дальнейшая судьба глюкозо-6-фосфата регулируется в основном противоположно направленным действием глюкагона и инсулина. Глюкагон запускает каскадный механизм регуляции, опосредуемый сАМР (разд. 16.15), что приводит к расщеплению гликогена, тогда как инсулин, будучи антагонистом глюкагона, оказывает противоположное действие. Высокая концентрация глюкозы приводит к пониженной секреции глюкагона и повышенной секреции инсулина поджелудочной железой. Вследствие этого при повышенном содержании глюкозы в крови быстро синтезируется гликоген. Эти гормональные воздействия на синтез и сохранение запасов гликогена усиливаются непосредственным действием самой глюкозы. Как обсуждалось ранее (разд. 16.18), фосфорилаза а, способная расщеплять гликоген, чувствительна к концентрации глюкозы. Когда концентрация глюкозы высока, связывание глюкозы с форфорилазой а делает ее чувствительной к действию фосфатазы, превращающей ее в фосфорилазу b. Фосфорилаза Ь неспособна расщеплять гликоген. Это превращение приводит также к высвобождению фосфатазы, что позволяет ей активировать гликоген-синтазу. Таким образом, глюкоза аллостерически переключает метаболизм гликогена с расщепления на синтез.
Рис. 23.18. Регуляция содержания глюкозы в крови печенью. А-после приема пищи, Б- утром натощак
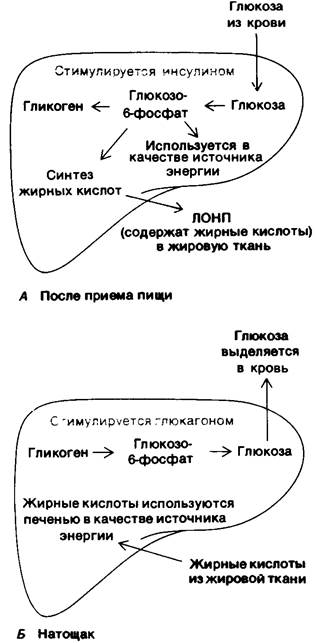
Высокое содержание инсулина после еды способствует также проникновению глюкозы в мышцы и жировую ткань. Инсулин стимулирует синтез гликогена как в мышцах, так и в печени. Благодаря большой массе мышцы могут запасать примерно втрое больше гликогена, чем печень. Поступление глюкозы в жировую ткань обеспечивает образование глицерол-3-фосфата для синтеза триацилглицеролов.
Содержание глюкозы в крови начинает снижаться через несколько часов после еды, что вызывает снижение секреции инсулина и повышение секреции глюкагона. Описанные выше процессы протекают в обратном направлении. Активация каскада реакций, опосредуемых сАМР, приводит к повышению концентрации фосфорилазы а и понижению концентрации гликоген-синтазы а. Действие гормонов на этот каскадный механизм усиливается пониженным связыванием глюкозы с фосфорилазой а, что делает ее менее чувствительной к гидролитическому действию фосфатазы. Вместо этого фосфатаза остается связанной с фосфорилазой а, так что гликоген-синтаза остается в неактивной фосфорилированной форме. Так осуществляется быстрая мобилизация гликогена. Большое количество глюкозы, которое образуется при гидролизе глюкозо-6-фосфата после расщепления гликогена, выделяется из печени в кровь. Пониженное потребление глюкозы мышцами и жировой тканью также вносит свой вклад в поддержание концентрации глюкозы в крови на определенном уровне. Поглощение глюкозы мышцами и жировой тканью снижается из-за низкой концентрации инсулина. При уменьшении концентрации глюкозы в крови и мышцы, и печень используют в качестве источника энергии жирные кислоты. Итак, концентрация глюкозы в крови удерживается на уровне выше примерно 80 мг/100 мл под действием трех основных факторов: мобилизации гликогена и высвобождения глюкозы печенью: выделения жирных кислот жировой тканью; переключения мышц и печени на использование в качестве источника энергии жирных кислот вместо глюкозы.
23.8. Адаптация метаболизма к продолжительному голоданию: снижение распада белков
Рассмотрим теперь, каким образом обмен веществ приспосабливается к продолжительному голоданию.
В организме взрослого неголодающего мужчины весом 70 кг энергетические ресурсы составляют в норме 1600ккал в виде гликогена, 24 000 ккал в виде мобилизуемого белка и 135 000 ккал в виде триацилглицеролов (табл. 23.1). Суточная потребность в энергии составляет от 1600 ккал в состоянии покоя до 6000 ккал в зависимости от степени активности. Таким образом, энергетический запас достаточен для обеспечения потребностей организма при голодании в течение 1-3 мес. Однако запас углеводов истощается всего лишь за сутки. Несмотря на это, концентрация глюкозы в крови поддерживается на уровне не ниже 50мг/100мл. Мозг не выдерживает даже кратковременного снижения концентрации глюкозы ниже этого уровня. Поэтому главная задача метаболизма при голодании- обеспечить достаточно высокую концентрацию глюкозы для мозга и других тканей (например, эритроцитов), которые полностью зависят от этого источника энергии. Однако в организме не слишком много предшественников глюкозы. Большая часть энергии запасается в форме остатков жирных кислот триацилглицеролов. Напомним, что жирные кислоты не могут превращаться в глюкозу, так как ацетил-СоА не превращается в пиру ват (разд. 17.14). Глицероловый компонент триацилглицеролов (триглицеридов) может превращаться в глюкозу, но он имеется лишь в ограниченном количестве. Остается только один потенциальный источник глюкозы-аминокислоты, образующиеся при распаде белков. Мышцы-самый богатый источник аминокислот при голодании. Однако выживание для большинства голодающих людей зависит от способности двигаться, а для этого требуется большая мышечная масса. Таким образом, вторая задача метаболизма при голодании-сохранить белки. Это достигается переключением метаболизма на такой путь, при котором в качестве источника энергии используется не глюкоза, а жирные кислоты и кетоновые тела (рис. 23.19).
Рис. 23.19. Содержание жирных кислот и кетоновых тел в сыворотке крови при голодании увеличивается, а содержание глюкозы уменьшается
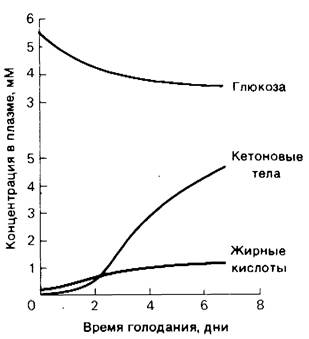
Метаболические изменения в течение первых суток голодания подобны состоянию организма натощак после ночного сна. Низкий уровень содержания сахара в крови приводит к снижению секреции инсулина и повышению секреции глюкагона. Доминирующие метаболические процессы-мобилизация триацилглицеролов в жировой тка
ни и глюконеогенез в печени. Печень получает энергию для своих нужд путем окисления жирных кислот, высвобождающихся из жировой ткани. Затем повышаются концентрации ацетил-СоА и цитрата, а это выключает гликолиз. Поглощение глюкозы мышцами существенно снижается из-за низкой концентрации инсулина, тогда как жирные кислоты свободно проникают в мышцы. Вследствие этого мышцы также переключаются с использования глюкозы в качестве источника энергии на использование жирных кислот. β-Окисление жирных кислот в мышцах останавливает превращение пирувата в ацетил-СоА. В результате пируват, лактат и аланин переносятся в печень, где они превращаются в глюкозу. Протеолиз мышечных белков дает часть этих трехуглеродных предшественников глюкозы. Другое сырье для синтеза глюкозы в печени - глицерол, образующийся при расщеплении триацилглицеролов.
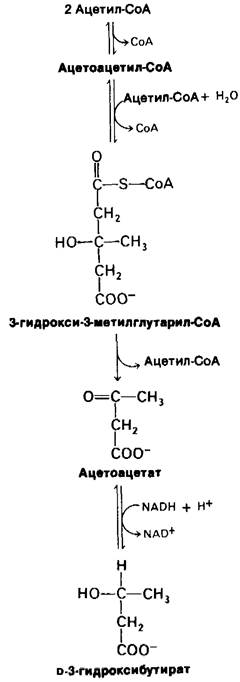
Важнейшее изменение, наступающее через трое суток голодания, образование в печени больших количеств ацетоацетата и β-гидроксибутирата (кетоновых тел) (рис. 23.20). Поскольку цикл трикарбоновых кислот не способен окислить все ацетильные группы, образующиеся при расщеплении жирных кислот, синтез кетоновых тел из ацетил-СоА существенно увеличивается. Глюконеогенез истощает запас оксалоацетата, необходимого для вступления ацетил-СоА в цикл трикарбоновых кислот. Это приводит к тому, что в печени образуются большие количества кетоновых тел, которые выделяются в кровь. К этому времени мозг начинает потреблять значительное количество ацетоацетата вместо глюкозы. Через три дня голодания примерно треть энергетических потребностей мозга удовлетворяется кетоновыми телами (табл. 23.2). Сердечная мышца также использует в качестве источника энергии кетоновые тела. Все эти изменения энергетического метаболизма называют кетозом.
Рис. 23.20. Синтез кетоновых тел в печени
Через несколько недель голодания кетоновые тела становятся основным источником энергии для мозга (табл. 23.2). Мозгу необходимо всего 40г глюкозы в сутки, тогда как в первый день голодания он потребляет 120 г. Интенсивное превращение жирных кислот в кетоновые тела в печени и их использование мозгом существенно снижают потребность в глюкозе. Поэтому распад мышечных белков снижается по сравнению с первыми днями голодания. Самое главное для выживания-расщепление 20 г мышечного белка вместо 75 г в начале голодания. Максимальная продолжительность голодания зависит от запаса триацилглицеролов.
Таблица 23.2. Энергетический метаболизм при голодании

23.9. Огромные запасы жира позволяют перелетным птицам покрывать большие расстояния
Еще одна удивительная иллюстрация биологической ценности триацилглицеролов- перелетные птицы. Некоторые небольшие наземные птицы улетают осенью со своих летних угодий в Новой Англии на зимовку в Вест-Индию и возвращаются весной. Они пролетают над водой без остановок 2400 км. Эти птицы поддерживают скорость 40 км/ч на протяжении 60 ч. Такой удивительный подвиг возможен благодаря большим запасам жира, которые эффективно используются во время долгого полета. Птицы, мигрирующие на короткие расстояния или вообще не мигрирующие, относительно тощи. Их жировой индекс составляет примерно 0,3; жировой индекс-отношение общего сухого веса жира тела к сухому весу тела птицы за вычетом жира. Птицы, мигрирующие на большие расстояния, наоборот, готовясь к перелету над сушей, накапливают довольно много жира, а непосредственно перед вылетом в путь над морем становятся весьма тучными. Жировой индекс достигает у них 3. У краснозобого колибри за сутки накапливается около 0,15 г гриацилглицеролов на 1г веса тела. У человека это соответствовало бы увеличению веса на 10 кг в сутки. Накопленный жир у перелетных птиц сохраняется под кожей, в брюшной полости, в мышцах и в печени. За время долгого перелета над водой расходуется около двух третей этого жирового запаса. Переход на использование в качестве источника энергии жирных кислот и кетоновых тел должен происходить очень быстро, так как за время 60-часового полета почти не происходит расщепления белка. Кроме того, окисление жира обеспечивает этих птиц водой, необходимой для восполнения потерь в дыхательных путях. Следует отметить высокую эффективность триацилглицеролов в качестве запасного источника энергии. Напомним, что в три- ацилглицеролах запасается в 6 раз больше энергии, чем в гликогене, так как они не содержат воды и находятся в более восстановленном состоянии (разд. 17.3). Перелетные птицы, у которых такое же количество энергетических ресурсов было бы запасено в виде гликогена, никогда не достигли бы суши!
