БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ОТВЕТЫ НА ВОПРОСЫ И ЗАДАЧИ
Глава 11
1. Реакции «а» и «в» направлены влево, реакции «б» и «г»-вправо.
2. Никак (использовать их для этой цели нельзя никак).
3. a) ∆G0' = + 7,5ккал/моль и Kéq= 3,16 • 10- 6. б) 3,16 • 104.
4. ∆G0,= 1,7 ккал/моль. Равновесное отношение составляет 17,8.
5. а) + 0,2 ккал/моль. б) - 7,8 ккал/моль. Гидролиз РРi направляет реакцию в сторону образования ацетил-СоА.
6. а) ∆G0 = 2,303 RTрК. б) — 6,53 ккал/моль при 25С.
7. ADP-компонент (или близкое к нему производное в случае СоА).
8. Активированной формой сульфата у большинства организмов служит З'-фосфоаденозин- 5'-фосфосульфат.
Глава12
1. a) Альдоза—кетоза; б) эпимеры; в) альдоза— —кетоза; г) аномеры; д) альдоза—кетоза; е) эпимеры.
2. Углерод метальной группы пирувата помечен 14С
3. a) ∆G0’ составляет — 29,5 ккал/моль для реакции
Глюкоза + 2Pi + 2ADP → 2 Лактат + 2АТР. 6) ∆G0' = - 27,2 ккал/моль.
4. 3,06 • 10-5.
5. Равновесные концентрации фруктозо-1,6-бис-фосфата, дигидроксиацетонфосфата и глицеральдегид-3-фосфата составляют соответственно 7,76 • 10-4, 2,24 • 10-4 и 2,24 • 10-4 М.
6. Все три углеродных атома 2,3-БФГ помечены С14. Атом фосфора, присоединенный к гидроксилу при С-2, помечен 32Р.
7. Гексокиназа в отсутствие сахара обладает низкой АТРазной активностью, потом} что она находится в каталитически неактивной конформации (разд. 12.12). Добавление ксилозы закрывает шель между двумя долями фермента. Однако в ксилозе отсутствует гидроксиметильная группа при С-6, и поэтому она не может фосфорилироваться. Взамен этого в месте, нормально занимаемом гидроксиметильной группой при С-6, роль акцептора фосфорильной группы, отделяющейся от АТР, выполняет молекула воды.
8. Рентгенокристаллографические исследования Winn S. I., Watson Н. С., Harkins R. N., Forther- gill L. A., Biochem. Soc. Frans., 5, 657-659 (1978) свидетельствуют о том, что 3-фосфоглицерат связывается активным центром фермента, в котором гистидин-184 находится в фосфорилированной форме, а гистидин-8-в свободной. Фос- фогистидин-184 переносит свою фосфорильную группу на субстрат, что приводит к образованию 2,3-бисфосфоглицерата. Фосфорильная группа в 3-м положении этого промежуточного продукта переносится далее к гистидину-8 с образованием 2-фосфоглицерата. Регенерирование исходной формы фермента осуществляется путем последующего переноса фосфорильной группы от гистидина-8 к гистидину-184. Отметим сходство этого каталитического механизма с таковым для бисфосфоглицератмутазы (разд. 12.17).
Глава 13
1. а) После одного оборота цикла трикарбоновых кислот метка появляется в С-2 и С-3 оксало- ацетата.
б) После одного оборота цикла трикарбоновых кислот метка появляется в С-1 и С-4 оксало- ацетата.
в) Метка появляется в СO2 при образовании ацетил-СоА из пирувата.
г, д) Судьба метки такая же, как в случае «а».
2. Нет, потому что два атома углерода теряются в цикле на двух стадиях декарбоксилирования. Следовательно, накопления оксалоацетата в указанных условиях происходить не может.
3. 0,90, 0,03 и 0,07.
4. - 9.8 ккал/моль.
5. Стереоспецифичность глицеральдегид-3-фосфат—дегидрогеназы в отношении кофермента противоположна таковой алкоголь-дегидрогеназы (тип В и тип А соответственно).
6. Тиаминтиазолонпирофосфат-аналог промежуточного переходного состояния. Серусолержащее кольцо этого аналога не несет заряда, и, следовательно он очень сходен с промежуточным состоянием нормального кофермента в реакциях, катализируемых тиамином (т. е. с несущей заряда резонансной формой гидроксиэтил-ТПФ, разд. 13.10).
7. Для образования оксалоацетата отношение малата к оксалоацетату должно превышать 1,75 • 104.
Глава 14
1. а) 15; б) 2; в) 38; г) 16; д) 36 и е) 19.
2. а) ∆Е'о для этой реакции равно + 1,05 В, ∆G0' составляет - 48,4 ккал/моль.
2Г-SH + 1/2О2 ⇄ Г-SS-Г + Н2О.
б) ∆Еô = + 0,09 В, ∆G0' составляет —4,15 ккал/моль.
3. а) Блокирует транспорт электронов и протонный насос в 3-м пункте.
б) Блокирует перенос электронов и синтез АТР путем ингибирования обмена АТР и ADP через внутреннюю минохондриальную мембрану.
в) Блокирует перенос электронов и протонный насос в 1-м пункте.
г) Блокирует синтез АТР путем нарушения протонного градиента, не подавляя при этом переноса электронов.
д) Блокирует перенос электронов и протонный насос в 3-м пункте.
е) Блокирует перенос электронов и протонный насос во 2-м пункте.
4. Олигомицин подавляет образование АТР, нарушая использование протонного градиента. Он не блокирует переноса электронов.
5. ∆G0' составляет + 16,1 ккал/моль для окисления с участием NAD+ и + 1,4 ккал/моль для окисления с участием FAD. Восстановление сукцината с участием NAD+ термодинамически невозможно.
6. Цианид может оказывать летальный эффект в результате связывания с ферриформой цитохрома (а + а3) и подавления вследствие этого окислительного фосфорилирования. Нитрит превращает феррогемоглобин в ферригемоглобин, который также связывает цианид. Таким образом ферригемоглобин конкурирует за цианид с цитохромом (а + а3). Эта конкуренция оказывает лечебное действие, потому что количество ферригемоглобина, которое может быть образовано без нарушения транспорта кислорода, значительно превышает количество цитохрома (а++ аз).
7. Доступная свободная энергия в результате транслокации 2, 3 и 4 протонов составляет соответственно — 9,23, - 13,8 и - 18,5 ккал. Свободная энергия, потребляемая в синтезе 1 моль АТР при стандартных условиях, равна 7,3 ккал. Следовательно, остающаяся свободная энергия величиной в - 1,93, - 6,5 и — 11,2 ккал может запускать синтез АТР до тех пор, пока отношение [ATP]/[ADP] [Р|] не составит соответственно 26,2, 6,51 • 104 и 1,62 • 108. Суспензии изолированных митохондрий синтезируют АТР, пока указанное соотношение не превысит 104. Из этого следует, что на один моль синтезируемого АТР транслоцируются минимум три протона.
Глава 15
1. а) 5 Глюкозо-6-фосфат + АТР → 6 Рибозо-5- фосфат + ADP + Н+.
б) Глюкозо-6-фосфат + 12NaDP+ + 7Н2О → 6СО2 + 12NADPH + 12Н+ + Рi.
2. Метка появляется при С-5 рибулозо-5-фосфата.
3. Окислительное декарбоксилирование изоцитрата в α-оксоглутарат. При обеих реакциях в качестве промежуточного продукта образуется β-оксокислота.
4. Во фруктозо-6-фосфате метка обнаруживается при С-1 и С-3, тогда как в эритрозо-4-фосфате метка отсутствует.
5. Блокируются реакции б и д.
6. Получить шиффово основание между кетозным субстратом и трансальдолазой, восстановить его тритированным NaBH4 и исследовать меченый фермент методом отпечатков пальцев.
Глава 16
1. Галактоза + АТР + UTP + Н2O + Гликоген n → Гликогенn+1 + ADP + UDP + 2Рi + Н+.
2. Фруктоза + 2 АТР + 2Н2O → Глюкоза + 2ADP + 2Pi.
3. Имеет место недостаточность ветвящего фермента.
4. При болезни Гирке повышена концентрация глюкозо-6-фосфата. Следовательно, при этом активна фосфорилированная D-форма гликоген-синтазы.
5. Глюкоза является аллостерическим ингибитором фосфорилазы а. Следовательно, кристаллы, растущие в ее присутствии, находятся в Т-состоянии. Добавление глюкозо-1-фосфата, субстрата фосфорилазы, сдвигает равновесие R ⇄ T в сторону R-состояния. Конформационные различия между этими состояниями достаточно велики, что может обусловить разрушение кристаллов, если они не стабилизированы перекрестными химическими связями. Разрушение кристалла, вызванное аллостерическим переходом, впервые описал Горовиц (Haurowitz) для оксигенирования кристаллов дезоксигемоглобина.
6. Хере (HersH.G., Ann. Rev. Biochem., 45, 167 (1976)] предположил, что кинетика указанных реакций обусловливает наличие лаг-периода в дефосфорилировании субъединицы В, благодаря чему распад гликогена может произойти до того, как будет инактивирована киназа фосфорилазы под действием ее фосфатазы.
Глава 17
1. а) Глицерол + 2NAD++ Pi + ADP → Пируват + ATP + Н2O + 2 NADH + Н+.
б) Глицеролкиназа и глицеролфосфат-дегидрогеназа.
2. Стеарат + АТР + 131/2 Н2O + 8 FAD + 8 NAD+ → 4 • 1/2Ацетоацетат + 12 • 1/2H+ + 8FADH2 + 8FADH + AMP + 2P.
3. а) Окисление в митохондриях, синтез в цитозоле.
б) Ацетил-СоА при окислении, ацил переносящий белок для синтеза.
в) FAD и NAD+ при окислении, NADPH для синтеза
г) L-Изомер 3-гидроксиацил-СоА при окислении. D-изомер при синтезе.
д) От карбоксила к метилу при окислении, от метила к карбоксилу при синтезе.
е) Ферменты синтеза жирных кислот, но не ферменты их окисления организованы в мультиферментный комплекс.
4. а) Пальмитолеат; б) линолеат; в) линолеат; г) олеат; д) олеат и е) линоленат.
5. Большей радиоактивностью обладает С-1 (см. обсуждение этого экспериментального подхода для выяснения направления синтеза полипептидной цепи в разд. 27.11).
6. а) Да.
2 Ацетил-СоА + ЗН2O + FAD + 2NAD+ → Оксалоацетат + 2СоА + FADH2 + 2NADH + 4Н+.
в) Да, потому что глюкоза может синтезироваться из оксалоацетата по пути глюконеогенеза.
Глава 18
1. а) Пируват; б) оксалоацетат; в) α-оксоглутарат; г) α-оксоизокапроат; д) фенилпируват и е) гидроксифенилпируват.
2. Аспартат + α-Оксоглутарат + GTP + АТР + 2 Н2O + NADH + Н+ → 1/2 Глюкоза + Глутамат + СO2 + ADP + GDP + NAD+ + 2Pi.
3. Аспартат + СO2 + NH +4 + 3 АТР + NAD+ +-4 Н2O → Оксалоацетат + Мочевина + 2 ADP + 4Pi + АМР + NADH + Н+.
4. а) Пометим 14С углеродный атом метильной группы L-метилмалонил-СоА. Определим локализацию 14С в сукцинил-СоА. Мигрирующая группа-та, которая связана с меченым атомом углерода.
б) Пометим 14С углеродный атом метильной группы L-метилмалонил-СоА и пометим 35S атом серы его СоА-компонента. Перенос группы-СО—S—СоА будет внутримолекулярным, если окажется, что сукцинил-СоА содержит и 14С, и 35S.
в) Протон метильной группы L-метилмалонил- СоА прямо переносится к соседнему углеродному атому.
5. Тиаминпирофосфат.
Глава 19
1. ∆Ео = + 0,28 В и ∆G0' = — 12,9 ккал/моль.
2. Альдолаза участвует в цикле Кальвина, тогда как трансальдолаза - в пентозофосфатном пути.
3. Концентрация 3-фосфоглицерата повысится, а концентрация рибулозо-1,5-бисфосфата снизится.
4. Концентрация 3-фосфоглицерата понизится, а концентрация рибулозо-1,5-бисфосфата повысится.
5. Фикоэритрин и фикоцианин служат антенными молекулами. Они поглощают свет в области спектра, в которой хлорофилл а обладает низким поглощением, и затем переносят свою энергию возбужденных электронов к хлорофиллу а.
6. а) Это является выражением ключевого аспекта фотосинтеза - вода расщепляется светом. Выделяющийся при фотосинтезе кислород происходит из воды.
б) Уравнение Ван Нила для дыхания отражает тот факт, что для сгорания глюкозы потребуется поступление шести молекул Н2O. См. интересную дискуссию о природе клеточного дыхания.
7. Добавление пиридина увеличивает способность полости тилакоидов накапливать протоны. Таким образом, большее количество протонов может протекать в темноте через АТР-синтезирующий комплекс.
8. Дихлорфенилдиметилмочевина (DCMU) подавляет перенос электронов между коферментом Q и пластихиноном в участке, связывающем между собой фотосистемы II и I. Выделение O2 может происходить в присутствии DCMU при условии наличия искусственного акцептора электронов, такого, как феррицианид, способного акцептировать электроны с кофермента Q.
Глава 20
1. Глицерол + 4 ATP 4- 3 Жирная кислота + 4 Н2О → Триацилглицерол + ADP + 3АМР + 7P¡ + 4Н+.
2. Глицерол + 3 АТР + 2 Жирная кислота + 2 Н2О + СТР + Серин → Фосфатидилсерин + CMP + ADP + 2АМР + 6P¡ + 3Н+
3. а) CDP-диацилглицерол; б) CDP-этаноламин; в) Ацил-СоА; г) CDP-холин; д) UDP-глюкоза или UDP-галактоза; е) UDP-галактоза; ж) ге- ранилпирофосфат.
4. а) и б) Метка не будет обнаруживаться нигде, так как она теряется в виде СО2.
Глава 21
1. Глюкоза + 2ADP + 2 P¡ + 2NAD++ 2 Глутамат → 2 Аланин + 2α-Оксоглутарат + 2 АТР + + 2NADH + Н+.
2. N2→ NH4 → Глутамат → Серин → Глицин → b!!!!!-Аминолевулинат→ Порфобилиноген → Гем.
3. а) Тетрагидрофолят; б) Тетрагидрофолят; в) N5-метилтетрагидрофолят.
4. Промежуточным продуктом реакции, возможно, является у-глутамилфосфат.
5. Введение глицина приводит к образованию изовалерилглицина. В отличие от валериановой кислоты это соединение водорастворимо и быстро выводится из почек.
6. Характер обмена H—D указывает, что в качестве промежуточного продукта образуется диимид.
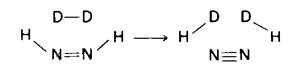
7. Они осуществляют азотфиксацию. Вследствие отсутствия фотосистемы II в них создается бескислородная среда. Напомним, что нитрогеназа очень быстро инактивируется кислородом.
Глава 22
1. Глюкоза + 2 АТР + 2NADP+ + Н2O → ФРПФ + СO2 + ADP + АМР + 2NADPH + Н+.
2. Глутамин + Аспартат + СO2 + 2 АТР + NAD+ → Оротат + 2ADP + 2 Pi + Глутамат + NADH + Н+.
3. а, в, г и д) ФРПФ; б) карбамоилфосфат.
4. ФРПФ и формилглицинамидрибонуклеотид.
5. dUMP + Серин + NADPH + Н+ → dTMP + NADP+ + Глицин.
6. Создается дефицит N10-формилтетрагидрофолята. Сульфаниламид ингибирует синтез фолиевой кислоты, так как представляет собой аналог одного из ее предшественников-n-аминобензойной кислоты.
7. ФРПФ является активированным промежуточным продуктом следующих биосинтетических путей: а) при синтезе фосфорибозиламина в процессе образования пуринов de novo; б) при синтезе пуриннуклеотидов из свободных оснований (путь синтеза из готовых остатков): в) при синтезе оротидиловой кислоты в процессе образования пиримидинов; г) при синтезе рибонуклеотида никатиновой кислоты: д) при образовании фосфорибозил-АТР в ходе синтеза гистидина; е) при образовании фосфорибозил- антранилата в процессе синтеза триптофана.
8. Скорее всего в результате каталитического действия малой субъединицы от глутамина отщепляется аммиак. Затем новообразованный аммиак реагирует с какой-то активированной формой СO2, которую образует большая субъединица. То, что субъединица обладает бикарбонат-зависимой АТРазной активностью, позволяет предположить, что активированная формакарбонилфосфат. В результате реакции этого смешанного углеродно-фосфорного ангидрида с NH3 образуется карбамат, который затем вступает в реакцию с АТР и дает карбамоилфосфат.