БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ II ГЕНЕРИРОВАНИЕ И ХРАНЕНИЕ МЕТАБОЛИЧЕСКОЙ ЭНЕРГИИ
ГЛАВА 16. ГЛИКОГЕН И ОБМЕН ДИСАХАРИДОВ
16.14. Гликоген-синтаза инактивируется при фосфорилировании специфического серинового остатка
Синтез гликогена тесно координирован с его расщеплением. Активность гликоген- синтазы, подобно активности фосфорилазы, регулируется путем ковалентной модификации. В результате фосфорилирования гликогенсинтаза а превращается в обычно неактивную форму b. Фосфорилированная b-форма (называвшаяся раньше D, или зависимая форма) требует для своей активности больших количеств глюкозо-6-фосфата, тогда как дефосфорилированная a-форма (ранее называемая I, или независимая форма) активна и в присутствии, и в отсутствие глюкозо-6-фосфата. Таким образом, фосфорилирование оказывает противоположно направленное действие на активности гликоген-синтазы и гликоген -фосфорилазы.
Рис. 16.7. Схематическое изображение димера фосфорилазы b по направлению оси симметрии второго порядка, показывающая расположение доменов и связывающих мест
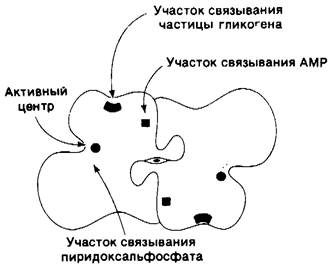
Рис. 16.8. Электронная микрофотография, на которой показана локализация частиц гликогена в сердечной мышце

16.15. Каскад реакций контролирует фосфорилирование гликоген-синтазы и гликоген-фосфорилазы
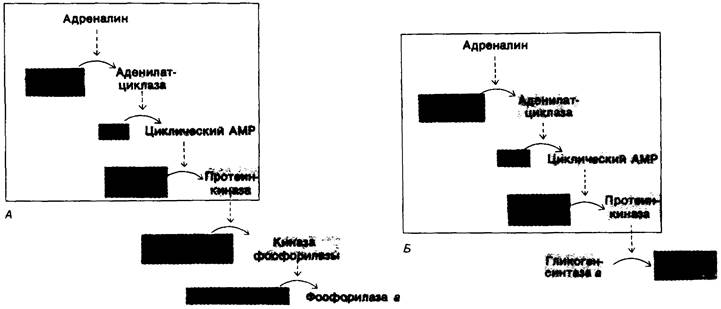
Рассмотрим теперь связь между гормонами, влияющими на обмен гликогена, и реакциями фосфорилирования, определяющими активности гликоген-синтазы и гликоген-фосфорилазы. При этом происходит следующая последовательность реакций (рис. 16.9):
1. Адреналин связывается с плазматической мембраной мышечной клетки и стимулирует аденилатциклазу.
2. Аденилатциклаза катализирует в плазматической мембране образование циклического АМР из АТР.
3. Повышенное внутриклеточное содержание циклического АМР активирует протеинкиназу. В отсутствие циклического АМР эта киназа неактивна, связывание циклического АМР приводит к ее аллостерической стимуляции (гл. 35).
4. Зависимая от циклического АМР протеинкиназа фосфорилирует киназу фосфорилазы и гликоген-синтазу. Фосфорилирование обоих ферментов лежит в основе координированной регуляции синтеза и расщепления гликогена. Оно приводит к «включению» фосфорилазы (при посредстве киназы фосфорилазы) и к одновременному «выключению» гликоген-синтазы (прямым путем).
Рис. 16.9. Каскады реакций, регулирующих обмен гликогена: A-распад гликогена; Б-синтез гликогена. Неактивные формы ферментов показаны красным, активные-зеленым цветом. Последовательность реакций, приводящих к активации протеинкиназы, одна и та же для регуляции распада и для регуляции синтеза гликогена
16.16. Фосфатазы вызывают обращение регуляторных эффектов киназ
Изменения ферментативной активности, вызываемые фосфорилированием, могут быть обращены путем гидролитического удаления фосфорильной группы. Например, превращение фосфорилазы а в фосфорилазу b катализируется фосфатазой фосфорилазы.
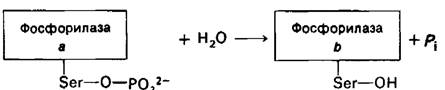
Данный фермент гидролизует также фосфорильную группу активной формы киназы фосфорилазы, вызывая ее инактивацию. Кроме того, эта же фосфатаза удаляет фосфорильиую группу из гликоген- синтазы 6, превращая ее в значительно более активную a-форму. Таково еще одно молекулярное устройство, обеспечивающее координированный синтез и расщепление гликогена. Активность фосфатаз также, по- видимому, регулируется. Например, сочетание Са2+ и Mg-ATP ингибирует фосфатазу фосфорилазы, но активирует киназу фосфорилазы. Фосфатаза гликоген-синтазы в мышцах ингибируется гликогеном. Поэтому при высоком содержании гликогена мышечная гликоген-синтаза будет оставаться в фосфорилированной b-форме.
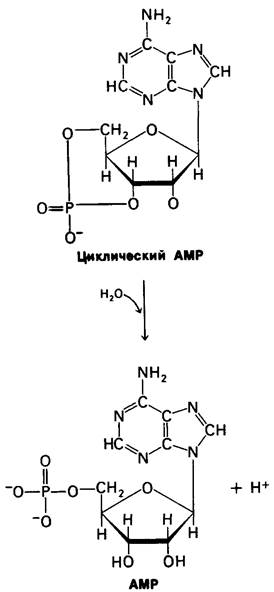
Сигнал, возникающий при образовании циклического АМР, также может быть «выключен». Фосфодиэфирная связь в циклическом АMР гидролизуется специфической фосфодиэстеразой с образованием АМР, который не активирует протеинкиназу. Значение ∆G0' этой высокоэкзергониче- ской реакции составляет — 11,9 ккал/моль.
16.17. Каскад реакций амплифицирует гормональный сигнал
Каскад ферментативных реакций в регуляции обмена гликогена аналогичен каскаду протеолитических реакций при свертывании крови (разд. 8.17). В обоих случаях ферментативный каскад создает высокую степень амплификации. В случае распада гликогена имеются три ферментативные стадии контроля, тогда как при синтезе гликогена таких стадий две. Если бы имела место прямая регуляция гликоген-фосфорилазы и гликоген-синтазы путем связывания адреналина, количество гормона, необходимое для усиления распада гликогена, было бы более чем в тысячу раз выше того количества, которое требуется в присутствии амплифицирующего каскада.