БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ II ГЕНЕРИРОВАНИЕ И ХРАНЕНИЕ МЕТАБОЛИЧЕСКОЙ ЭНЕРГИИ
ГЛАВА 17. ОБМЕН ЖИРНЫХ КИСЛОТ
17.14. Животные неспособны превращать жирные кислоты в глюкозу
Важно отметить, что животные неспособны превращать жирные кислоты в глюкозу. Ацетил-СоА не может превратиться в организме животных в пируват или оксалоацетат. Два углеродных атома ацетильной группы ацетил-СоА включаются в цикл трикарбоновых кислот, но два атома углерода покидают этот цикл в ходе реакций декар- боксилирования, катализируемых изоцитрат-дегидрогеназой и α-оксоглутарат - дегидрогеназой. Следовательно, оксалоацетат регенерируется, но не образуется заново при окислении ацетильного компонента ацетил- СоА в цикле трикарбоновых кислот. В отличие от животных растения обладают двумя дополнительными ферментами, обусловливающими их способность к превращению углеродных атомов ацетил-СоА в глюкозу.
17.15. Синтез и распад жирных кислот идут различными путями
Путь синтеза жирных кислот-это отнюдь не обращение пути их расщепления. Он представляет собою новую последовательность реакций, что служит еще одним примером различий путей синтеза и расщепления в биологических системах. Рассмотрим некоторые важные особенности пути биосинтеза жирных кислот.
1. Синтез происходит в цитозоле в отличие от распада, который протекает в митохондриальном матриксе.
2. Промежуточные продукты синтеза жирных кислот ковалентно связаны с сульфгидрильными группами ацилпереносящего белка (АПБ), тогда как промежуточные продукты расщепления жирных кислот связаны с коферментом А.
3. Многие ферменты синтеза жирных кислот у высших организмов организованы в мулътиферментный комплекс, называемый синтетазой жирных кислот. В противоположность им ферменты, катализирующие расщепление жирных кислот, по- видимому, не склонны к ассоциации.
4. Растущая цепь жирной кислоты удлиняется путем последовательного присоединения двухуглеродных компонентов, происходящих из ацетил-СоА. Активированным донором двухуглеродных компонентов на стадии элонгации служит малонил-АПБ. Реакция элонгации запускается высвобождением CO2.
5. Роль восстановителя при синтезе жирной кислоты выполняет NАDРН.
6. Элонгация под действием комплекса синтетазы жирных кислот останавливается на этапе образования пальмитата (С16). Дальнейшая элонгация и введение двойных связей осуществляются другими ферментными системами.
17.16. Образование малонилкофермента А- решающий шаг в синтезе жирных кислот
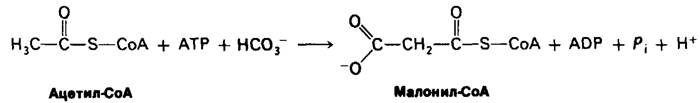
Обнаруженная Сэли Уейкил (Salih Wakil) потребность в бикарбонате для биосинтеза жирных кислот оказалась ключом к раскрытию механизма этого процесса. Действительно, синтез жирных кислот начинается с карбоксилирования ацетил-СоА в малонил-СоА. Эта необратимая реакция представляет собою решающий этап в синтезе жирных кислот.
Синтез малонил-СоА катализируется ацетил-СоА-карбоксилазой, содержащей в качестве простетической группы биотин. Карбоксильная группа биотина ковалентно присоединяется к ε-аминогруппе остатка лизина, как это имеет место в пируваткар- боксилазе (разд. 15.15). Еще одно общее свойство ацетил-СоА-карбоксилазы и пи- руваткарбоксилазы заключается в том, что карбоксилирование ацетил-СоА происходит в две стадии. Сначала за счет АТР образуется в качестве промежуточного продукта кар- боксибиотин. Активированная СO2-группа в составе этого промежуточного продукта затем переносится на ацетил-СоА с образованием малонил-СоА.
Биотин - фермент + ATP + НСО3 -⇄ СO2 ~ Биотин-фермент + ADP + Pi.
СO2 ~ Биотин - фермент + Ацетил-СоА ⇄ Малонил-СоА + Биотин-фермент.
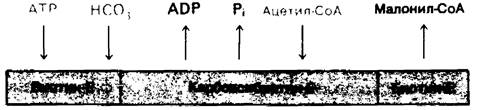
Связывание субстратов с ферментом и освобождение продуктов происходят со специфической последовательностью (рис. 17.8). Ацетил-СоА - карбоксилаза представляет пример механизма реакции по типу «пинг- понга», когда освобождение одного или более продуктов реакции происходит до того, как все субстраты будут связаны.
Рис. 17.8. Последовательность реакций, катализируемых ацетил-СоА - карбоксилазой
Ацетил-СоА - карбоксилаза из Е. соli была разделена на субъединицы, катализирующие частичные реакции. Биотин ковалентно присоединяется к небольшому белку (22 кДа), называемому карбоксибиотин-переносящий белок. Карбоксилирование биотинового компонента в образованном комплексе катализируется второй субъединицей - биотин-карбоксилазой. Третьим компонентом системы является транскарбоксилаза, которая катализирует перенос активированного СO2 от карбоксибиотина на ацетил-СоА. Длина и гибкость связи между биотином и переносящим его белком обусловливают возможность перемещения активированной карбоксильной группы от одного активного центра ферментного комплекса к другому (рис. 17.9), как это имеет место в пируват-карбоксилазе (разд. 15.16).
У эукариот ацетил-СоА-карбоксилаза существует в виде лишенного ферментативной активности протомера (450 кДа) или в виде активного нитевидного полимера (рис. 17.10). Их взаимопревращение регулируется аллостерически, как и следовало ожидать, поскольку ацетил-СоА-карбоксилаза катализирует первый решающий этап в синтезе жирных кислот. Ключевым аллостерическим активатором служит цитрат, который сдвигает равновесие в сторону активной волокнистой формы фермента. Оптимальная ориентация биотина по отношению к субстратам достигается в волокнистой форме. В противоположность цитрату пальмитоил-СоА сдвигает равновесие в сторону неактивной протомерной формы. Таким образом, палъмитоил-СоА, конечный продукт, ингибирует первый решающий этап в биосинтезе жирных кислот. Регуляция ацетил-СоА -карбоксилазы у E. coli резко отличается от таковой у эукариот. У бактерий жирные кислоты являются прежде всего предшественниками фосфолипидов, а не резервным топливом, и поэтому контроль их синтеза носит другой характер. Цитрат не оказывает действия на ацетил-СоА -карбоксилазу E. coli. Активность транскарбоксилазного компонента системы регулируется гуа- ниновыми нуклеотидами, которые координируют синтез жирных кислот с ростом и делением бактерий.
Рис. 17.9. Схема, показывающая предполагаемое перемещение биотиновой простетической группы от места, где она присоединяет карбоксильную группу от НСО3- , к месту, где она отдает эту группу ацетил- СоА
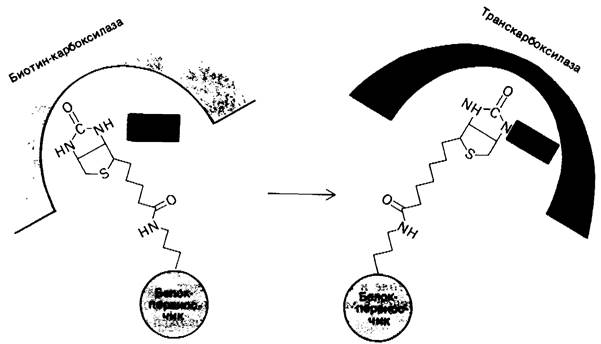
Рис.17.10. Электронная микрофотография активной нитевидной формы ацетил-СоА-карбоксилазы из печени цыпленка
