БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ II ГЕНЕРИРОВАНИЕ И ХРАНЕНИЕ МЕТАБОЛИЧЕСКОЙ ЭНЕРГИИ
ГЛАВА 18. РАЗРУШЕНИЕ АМИНОКИСЛОТ И ЦИКЛ МОЧЕВИНЫ
Избыток аминокислот относительно того их количества, которое требуется для синтеза белков и других биомолекул, в отличие от жирных кислот и глюкозы не может запасаться и не выделяется из организма. Избыточные аминокислоты используются как метаболическое топливо, α-Аминогруппа при этом отделяется, и остающийся углеродный скелет превращается в основные промежуточные продукты обмена веществ. Большинство аминогрупп избыточных аминокислот расходуется на образование мочевины, тогда как их углеродные скелеты трансформируются в ацетил-СоА, ацетоацетил-СоА, пируват или один из промежуточных продуктов цикла трикарбоновых кислот. Следовательно, жирные кислоты, кетоновые тела и глюкоза могут быть образованы из аминокислот.
18.1. α-Аминогруппы превращаются в ион аммония при окислительном дезаминировании глутамата
У млекопитающих аминокислоты разрушаются в основном в печени. Сначала мы рассмотрим судьбу α-аминогруппы, затем- судьбу углеродного скелета. α-Аминогруппа большинства аминокислот переносится на α-оксоглутарат с образованием глутамата, который подвергается далее окислительному дезаминированию с образованием.
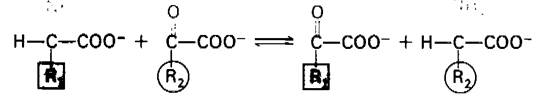
Перенос α-аминогруппы от α-аминокиелоты на α-оксокислоту катализируется ами- нотрансферазами, называемыми также трансаминазами.
Глутамат-аминотрансфераза, наиболее важный из этих ферментов, катализирует перенос аминогруппы на α-оксоглутарат.
α-Аминокислота + α-Оксоглутарат ⇄ α- Оксокислота + Глутамат.
Аланин-аминотрансфераза, также преобладающая в тканях млекопитающих, катализирует перенос аминогруппы на пируват,
α-Аминокислота + Пируват ⇄ α-Оксокислота + Аланин.
Образовавшийся при этом аланин может передавать свою аминогруппу на α-оксоглутарат с образованием глутамата. Две названные амипотрансферазы играют роль своего рода «воронок», направляющих аминогруппы от различных аминокислот в глутамат для последующего превращения в NН4.
Ион аммония образуется из глутамата путем окислительного дезаминирования. Реакция катализируется глутамат-дегидрогеназой, которая обладает необычной способностью использовать как NAD +, так и NADР+.
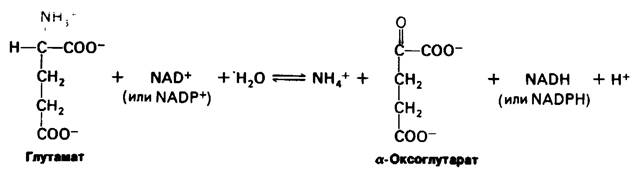
Активность глутамат-дегидрогеназы регулируется аллостерически. Фермент позвоночных состоит из шести идентичных субъединиц, способных к дальнейшей полимеризации. Гуанозинтрифосфат (GTP) и аденозинтрифосфат (АТР) являются аллостерическими ингибиторами, тогда как гуанозинди- фосфат (GDP) и аденозиндифосфат (ADP) служат аллостерическими активаторами. Следовательно, снижение энергетического заряда ускоряет окисление аминокислот. Превращения, катализируемые амино- трансферазами и глутамат-дегидрогеназой, описываются следующей суммарной реакцией;
α-Аминокислота + NAD+ + Н2O ⇄ α-Оксокислота + NH+4+ NADH + H+
(или NADP+) (или (NADPH).
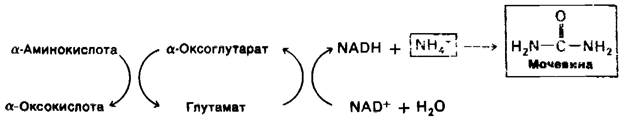
У сухопутных позвоночных превращается в мочевину, которая затем выделяется с мочой. Синтез мочевины мы рассмотрим в дальнейшем.
18.2. Пиридоксальфасфат, простетическая группа аминотрансфераз, образует в качестве промежуточных продуктов шиффовы основания
Простетической группой всех аминотрансфераз служит пиридоксальфосфат (ПЛФ), являющийся производным пиридоксипа (витамина В6). В процессе трансаминирования происходит временное превращение пиридоксальфосфата в пиридоксаминфосфат (ПМФ).
ПЛФ-ферменты образуют с субстратами в качестве промежуточных продуктов шиффовы основания. В отсутствие субстрата альдегидная группа пиридоксалъфосфата связана в шиффовом основании с ε-аминогруппой специфического остатка лизина в активном центре. При добавлении аминокислотного субстрата образуется новое шиффово основание, α-Аминогруппа аминокислотного субстрата замещает в активном центре ε-NH2-группу лизина. Образующееся шиффово основание между аминокислотой и пиридоксальфосфатом остается прочно связанным с ферментом нековалентными связями.
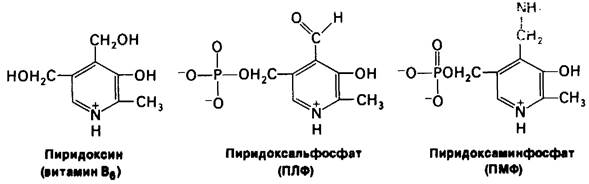
Рис. 18.1. Пространственная модель пиридоксальфосфата
Это шиффово основание и шиффово основание между пиридоксальфосфатом и лизином активного центра представляют собою альдимины. В ходе катализа изменяется положение двойной связи в шиффовом основании между аминокислотой и пиридоксаль- фосфатом и образуется кетимин, который далее гидролизуется на пиридоксаминфосфат и α-оксокислоту. Механизм реакции, предложенный Эсмондом Снеллом (Esmond Snell) и Александром Браунштейном, показан на рис. 18.2. Лизин активного центра или другая основная группа, занимающая соответствующее положение, вероятно, облегчает превращение альдимина в кетимин, выполняя функцию улавливателя электронов. Эти превращения составляют половину суммарной реакции:
Аминокислота1 + Е-ПЛФ ⇄ α-Оксокислота + Е-ПМФ.
Рис. 18.2. Предложенный механизм для реакций трансаминирования
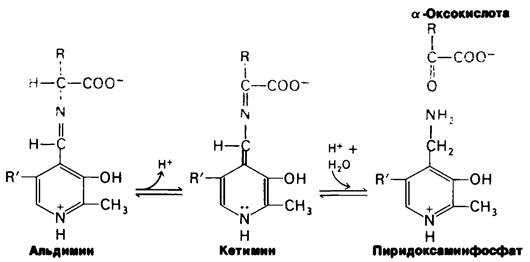
Вторая половина суммарной реакции состоит в обращении вышеуказанного пути. Вторая α-оксокислота реагирует с комплексом фермент - пиридоксаминфосфат (Е-ПМФ), что приводит к образованию второй аминокислоты и регенерированию комплекса фермент - пиридоксальфосфат (Е-ПЛФ).
α-Оксокислота2 + Е-ПМФ ⇄ Аминокислота 2 + Е-ПЛФ,
Суммарное уравнение этих частичных реакций имеет следующий вид:
Аминокислота1+ α-Оксокислота2⇄ Аминокислота2 + α-Оксокислота1.
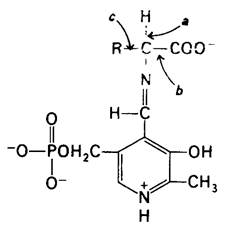
Каталитическое многообразие ферментов, содержащих в качестве простетической группы пиридоксальфосфат, замечательно, Трансаминирование-как раз одно из многих превращений аминокислот, катализируемых этими ферментами. Другие реакции с участием α-углеродного атома аминокислот представлены процессами декарбоксилирования, дезаминирования, рацемизации и альдольного расщепления (рис. 18.3). Кроме того, пиридоксальфосфатные ферменты катализируют реакции элиминирования и замещения при β-углеродном атоме (например, триптофан-синтаза; разд. 21.9) и у- углеродном атоме (например, цистатионаза; разд. 21.8) аминокислотных субстратов. Все эти реакции имеют следующие общие черты. Во-первых, происходит образование шиффова основания между аминокислотным субстратом (аминный компонент) и пиридоксальфосфатом (карбонильный компонент). Во-вторых, ПЛФ действует как улавливатель электронов, стабилизируя отрицательно заряженные промежуточные продукты каталитического процесса. Азот в кольце ПЛФ «притягивает» электроны из аминокислотного субстрата. Иными словами, ПЛФ представляет собою электрофильный катализатор. В-третьих, образовавшееся шиффово основание далее подвергается гидролизу.
Рис. 18.3. Пиридоксальфосфатные ферменты лабилизируют одну из трех связей при α-углеродном атоме аминокислотного субстрата. Например, связь а лабилизируется трансаминазами, связь b-декарбоксилазами и связь с- альдолазами (такими, как треонин-альдолаза). Пиридоксальфосфатные ферменты катализируют также реакции при β- и у-углеродных атомах аминокислот