БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ II ГЕНЕРИРОВАНИЕ И ХРАНЕНИЕ МЕТАБОЛИЧЕСКОЙ ЭНЕРГИИ
ГЛАВА 18. РАЗРУШЕНИЕ АМИНОКИСЛОТ И ЦИКЛ МОЧЕВИНЫ
18.9. Семейство С4-аминокислот: аспартат и аспарагин превращаются в оксалоацетат
Аспартат, аминокислота, содержащая четыре атома углерода, прямо трансаминирует- ся в оксалоацетат, промежуточный продукт цикла трикарбоновых кислот:
Аспартат + α-Оксоглутарат ⇄ Оксалоацетат + Глутамат.
Аспарагин гидролизуется под действием аспарагиназы, образуя NН4+ и аспартат, который затем подвергается трансаминированию.
Напомним, что аспартат может также превращаться в фумарат через цикл мочевины (разд. 18.5). Фумарат служит «пунктом входа» для половины углеродных атомов тирозина и фенилаланина, что будет вкратце обсуждено ниже.
18.10. Семейство С5-аминокислот: некоторые аминокислоты превращаются
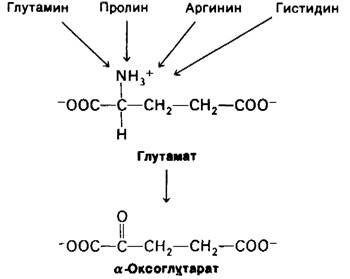
в α-оксоглутарат через глутамат Углеродные скелеты некоторых пятиуглеродных аминокислот включаются в цикл трикарбоновых кислот в виде α-оксоглутарата. Эти аминокислоты превращаются в глутамат, который затем подвергается окислительному дезаминированию под действием глутамат-дегидрогеназы с образованием α-оксоглутарата (рис. 18.8).
Рис. 18.8. α-Оксоглутарат - «пункт входа» для некоторых С5-аминокислот, которые сначала превращаются в глутамат
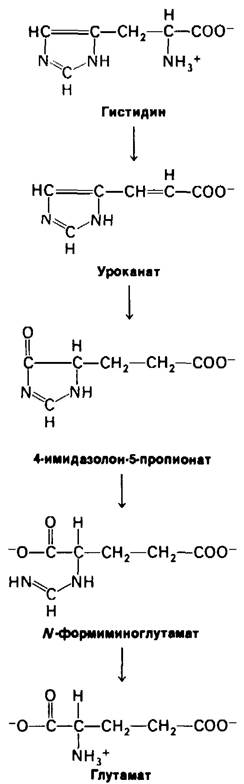
Гистидин превращается в 4-имидазолон-5-пропионат (рис. 18.9). Амидная связь в кольце этого промежуточного продукта гидролизуется с образованием N-формиминопроизводного глутамата, которое далее превращается в глутамат путем переноса его формиминовой группы на тетрагидрофолят, переносчик активированных одноуглеродных фрагментов (разд. 21.6).
Рис. 18.9. Превращение гистидина в глутамат
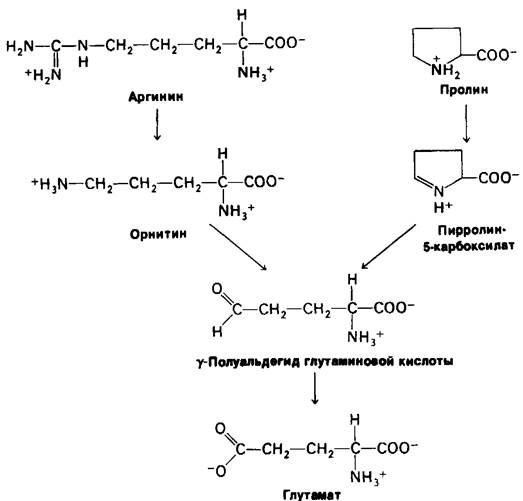
Глутамин гидролизуется глутаминазой с образованием глутамата и NH4+. Пролин и аргинин превращаются в у-полуальдегид глутаминовой кислоты, который затем окисляется в глутамат (рис. 18.10).
Рис. 18.10. Превращение пролина и аргинина в глутамат
18.11. Сукцинил-кофермент А-пункт включения в цикл трикарбоновых кислот для некоторых аминокислот
Сукцинил-СоА является тем соединением («пунктом входа»), в виде которого происходит включение в цикл трикарбоновых кислот некоторых углеродных атомов метионина, изолейцина, треонина и валина. Промежуточным продуктом, образующимся при распаде этих четырех аминокислот, служит метилмалонил-СоА (рис. 18.11).
Рис. 18.11. Превращение метионина, изолейцина, треонина и валина в сукцинил-СоА
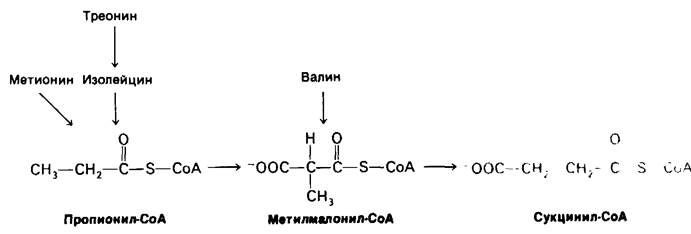
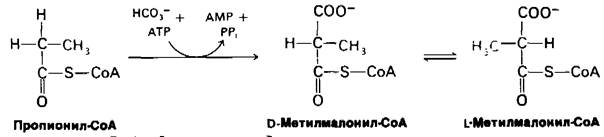
Особенно интересен путь от пропионил- СоА к сукцинил-СоА. Пропионил-СоА в присутствии избытка АТР карбоксили- руется с образованием D-изомера метилма- лонил-СоА. Эта реакция карбоксилирова- ния катализируется пропионил-СоА—карбоксилазой, биотиновым ферментом, каталитический механизм которого сходен
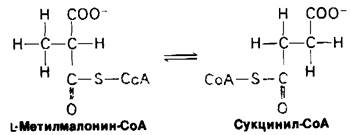
с таковым ацетил-СоА—карбоксилазы и пируват-карбоксилазы. D-изомер метил- малонил-СоА рацемизуется в L-изомер, который служит субстратом для мутазы, превращающей его в сукцинил-СоА.
Сукцинил-СоА ооразуется из L-метилма- лонил-СоА в результате внутримолекулярной перегруппировки. Группа—СО—S—СоА мигрирует от С-2 к С-3 в обмен на атом водорода. Эта очень необычная изомеризация катализируется метилмалонил-СоА—- мутазой, одним из двух известных ферментов млекопитающих, содержащих в качестве кофермента производное витамина В12.
Путь от пропионил-СоА к сукцинил-СоА участвует также в окислении жирных кислот с нечетным числом атомов углерода. В результате последней реакции тиолитического расщепления ацил-СоА с нечетным количеством углеродных атомов образуются ацетил-СоА и пропионил- СоА (разд. 17.11).