БИОХИМИЯ - Л. Страйер - 1984
ТОМ 2
ЧАСТЬ II ГЕНЕРИРОВАНИЕ И ХРАНЕНИЕ МЕТАБОЛИЧЕСКОЙ ЭНЕРГИИ
ГЛАВА 19. ФОТОСИНТЕЗ
19.12. При циклическом переносе электронов через фотосистему I может образовываться также АТР
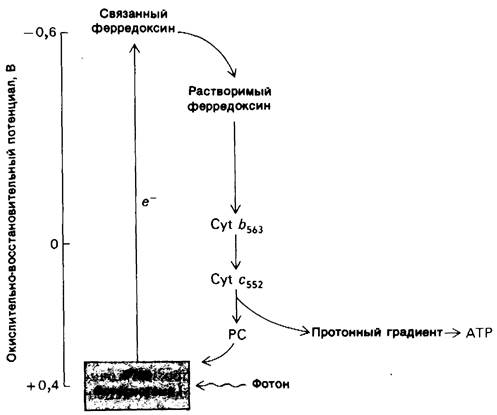
Существует другой путь переноса электронов, происходящих из Р700, реакционного центра фотосистемы I. Электрон с высоким потенциалом в связанном ферредоксине может переноситься не на NADP +, а на цитохром b563. Затем происходит обратный поток этого электрона к осиленной форме Р700 через цитохром с552 и пластоцианин. Другими словами, имеет место циклический поток электронов. При возвращении электронов в реакционный центр через цитохром b563 и пластоцианин происходит генерирование АТР. Поэтому описанный процесс называется циклическим фотофосфорилированием (рис. 19.16). При действии этого механизма генерирование АТР не сопровождается одновременным образованием NADPH. Фотосистема II не участвует в циклическом фосфорилировании, и, следовательно, образования O2 из Н2O не происходит, Циклическое фотофосфорилирование активно функционирует, когда содержание NADP оказывается ниже, чем это необходимо для акцептирования электронов от восстановленного ферредоксина. Такое состояние возникает при высоком соотношении [NADPH]/[NADP+ ].
Рис. 19.16. Поток электронов при циклическом фотофосфорилировании. Поглощение фотона сопровождается переносом электронов с Р700, реакционного центра фотосистемы I, на связанный ферредоксии. Электроны возвращаются на Р700
19.1З. Протонный градиент через мембрану тнлакоидов запускает синтез АТР
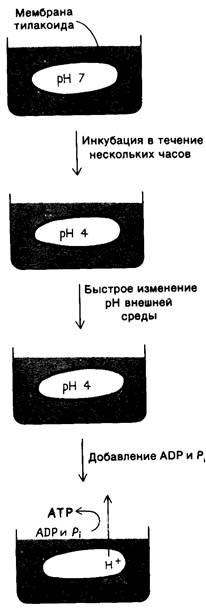
В 1966 г, Андре Ягендорф (André Jagendorf) показал, что хлоропласты синтезируют АТР в темноте при создании искусственного градиента pH через мембрану тилакоидов. Для возникновения такого преходящего градиента рн хлоропасты погружали на несколько часов в буфер с pH 4. Затем хлоропласты быстро смешивали с буфером pH 8, содержащим ADP и Рi. В результате pH стромы моментально возрастал до 8, тогда как pH полости тилакоидов оставался равным 4. Исчезновение возникшего градиента pH в мембране тилакоидов сопровождалось вспышкой синтеза АТР (рис. 19.17). Этот показательный эксперимент представляет собою сильный аргумент в пользу хе- миосмотической гипотезы синтеза АТР (разд. 14.5).
Рис. 19.17. Синтез ATP хлоропластами при наличии градиента pH
Действительно, механизм синтеза АТР в хлоропластах весьма близок к таковому в митохондриях. И при фотофосфорилировании, и при окислительном фосфорилировании образование АТР запускается протонодвижущей силой. Кроме того, ферментный ансамбль, катализирующий образование АТР в хлоропластах, называемый комплексом CF1—CF0(где С обозначает хлоропласт, a F-фактор), очень сходен с митохондриальным комплексом F1—F0. CF1 катализирует образование АТР из ADP и Рi. Он содержит пары пяти видов субъединиц и имеет массу 325 кДа. CF0, содержащий протонный канал, состоит из трех видов субъединиц. Выпячивания на наружной поверхности мембраны тилакоидов представляют собою СF1-компоненты этих АТР- синтезиру юших комплексов.
Перенос электрона через асимметрично ориентированные фотосистемы I и II создает большой протонный градиент через мембрану тилакоидов. Реакция среды в полости тилакоидов становится выраженно кислой-pH приближается к 4. Индуцированный светом трансмембранный протонный градиент составляет примерно 3,5 единицы pH. Как обсуждалось ранее (разд. 14.5), протонодвижущая сила ∆р складывается из градиента pH и мембранного потенциала. В хлоропластах почти вся величина Ар создается градиентом pH, тогда как в митохондриях более значителен вклад мембранного потенциала. Причина этого различия состоит в том, что мембрана тилакоидов полностью проницаема для С1 и Mg2+. Индуцируемый светом перенос Н+ в полость тилакоидов сопровождается или переносом Сl- в том же направлении, или переносом Mg2+ (одного на 2Н+) в противоположном направлении. Таким образом, при этом поддерживается электронейтральность и не происходит генерирования мембранного потенциала. Протонодвижущая сила через мембрану тилакоидов, равная 0,2 В, эквивалентна примерно 4,8 ккал на моль протонов. На одну молекулу синтезируемого АТР через комплекс CF1=-CF0 протекает около трех протонов, что соответствует потреблению свободной энергии в количестве 14А ккал в расчете на моль АТР. Когда градиент pH меньше двух единиц, синтеза АТР не происходит, потому что при этом слишком мала движущая сила.
CF1 находится на обращенной к строме поверхности мембраны тилакоидов, и, следовательно, синтезированный АТР высвобождается в полость стромы. Подобно этому высвобождается в полость стромы и NADPH, образованный фотосистемой I, Таким образом, АТР и NADPH, продукты световых реакций фотосинтеза, локализо
ваны таким образом, чтобы обеспечить последующие темповые реакции, в ходе которых происходит превращение СO2 в углеводы.
19.14. Исследование пути углерода с использованием импульсной радиоактивной метки
В 1945 г. Мелвин Кальвин (Melvin Calvin) и его сотрудники начали серию исследований, проливших свет на темновые реакции фотосинтеза. Они использовали в своей работе одноклеточную зеленую водоросль Chlorella, поскольку этот организм легко и с высокой воспроизводимостью культивируется. Позднее оказалось, что полученные ими результаты могут быть распространены на большое множество фотосинтезирующих организмов, от фотосинтезирующих бактерий до высших растений.
Целью, предпринятой ими работы, было выяснение пути, обеспечивающего фиксацию СO2 с образованием углевода. Стратегия эксперимента состояла в том, чтобы, используя метку 14С, проследить превращения СO2. Радиоактивный 14СO2 вводили в освещаемую суспензию водоросли, в которой протекал фотосинтез с использованием обычного СO2. По прошествии определенного времени водоросль убивали, вливая суспензию в спирт, что блокировало все ферментативные реакции.
Радиоактивные соединения водоросли разделяли и идентифицировали методом двухмерной хроматографии на бумаге. Бумажные хроматограммы помещали затем под пресс вместе с фотопленкой, которая чернела в тех местах, где на бумаге находилось радиоактивное пятно. В своей Нобелевской лекции Кальвин отметил, что их первоначальные данные относились «к количеству, положению и интенсивности обусловленных радиоактивностью почерневших участков. К сожалению, бумага сама не печатает названия этих соединений, и в течение последующих десяти лет наше основное занятие состояло в том, чтобы правильно определить природу соединений на этих почерневших участках пленки».