БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
Часть IV ИНФОРМАЦИЯ
ГЛАВА 24 ДНК: ГЕНЕТИЧЕСКАЯ РОЛЬ, СТРУКТУРА И РЕПЛИКАЦИЯ
24.23. Сложность аппарата репликации, по-видимому, необходима для обеспечения очень высокой надежности
Существующие представления о молекулярном механизме репликации ДНК у E. coli представлены на рис. 24.44 и в табл. 24.2. Поражает сложность взаимодействий множества белков, участвующих в этом процессе. Генетический анализ показывает, что в репликации ДНК непосредственно участвует не менее 15 белков. Почему механизм репликации ДНК столь сложен? В частности, почему синтез ДНК начинается с РНК- затравки, которая затем удаляется? Если бы ДНК-полимеразы могли начинать синтез цепей de novo, в РНК-затравке не было бы надобности. Однако такая способность была бы несовместима с чрезвычайно высокой точностью ДНК-полимераз. Напомним, что ДНК-полимеразы, прежде чем образовать новую фосфодиэфирную связь, проверяют правильность предшествующей пары оснований. Эта функция редактирования существенно снижает частоту ошибок. РНК-полимеразы, напротив, могут начинать синтез цепей de novo, так как они не проверяют
предыдущую пару оснований. Частота ошибок для них на несколько порядков величины выше, чем для ДНК-полимераз. Было найдено остроумное решение этой проблемы: начинать синтез ДНК с полинуклеотида, синтезируемого с низкой надежностью, но отмечать его «временный» характер, включив в его состав рибонуклеотиды. Затем ДНК-полимераза I вырезает эти короткие последовательности РНК-за- травок и замещает их последовательностью ДНК, синтезированной с высокой надежностью. Создается впечатление, что многие детали, усложняющие механизм репликации ДНК, предназначены для обеспечения чрезвычайно высокой точности. Генетический анализ показывает, что частота ошибок составляет одну на 109-1010 считанных пар оснований.
Рис. 24.44. Схематическое изображение ферментативных процессов в области репликационной вилки Е. coli. Фрагменты, отмеченные синим цветом, катализируют инициацию, элонгацию и сшивание (с помощью ДНК- лигазы) цепей ДНК
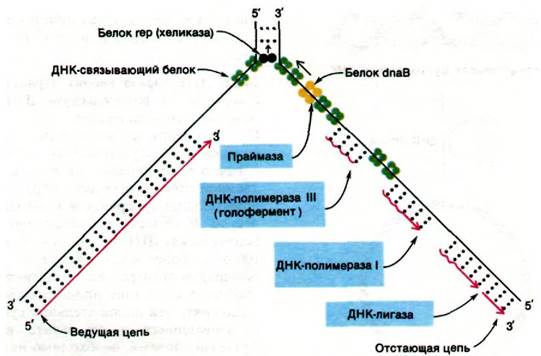
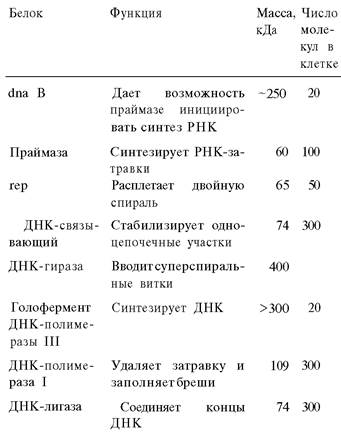
Таблица 24.2. Белки репликации Е. coli
24.24. Повреждения ДНК постоянно репарируются
Поскольку множество химических и физических агентов вызывает в ДНК повреждения, во всех клетках имеются специальные механизмы для исправления этих повреждений. Основания в ДНК могут изменяться и теряться, фосфодиэфирные связи остова могут разрываться, а две цепи могут поперечно сшиваться друг с другом. Эти повреждения образуются под действием ионизирующей радиации, ультрафиолетового облучения и различных химических веществ. Многие повреждения в ДНК поддаются исправлению, так как генетическая информация записана в обеих цепях двойной спирали. Благодаря этому информацию, утраченную одной из цепей, можно извлечь из другой цепи.
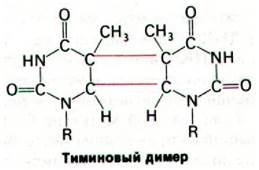
Один из наиболее хорошо изученных механизмов репарации - вырезание пиримидинового димера (рис. 24.45), который образуется при действии на ДНК ультрафиолетового света. Соседние пиримидиновые остатки в одной цепи ДНК могут в этих условиях образовать ковалентную сшивку. Такой пиримидиновый димер не укладывается в двойную спираль, так что репликация и экспрессия генов оказываются блокированными до тех пор, пока повреждение не будет удалено.
Рис. 24.45. Модель димера урацила, образованного под действием ультрафиолетового облучения. Тиминовый димер имеет примерно такую же структуру
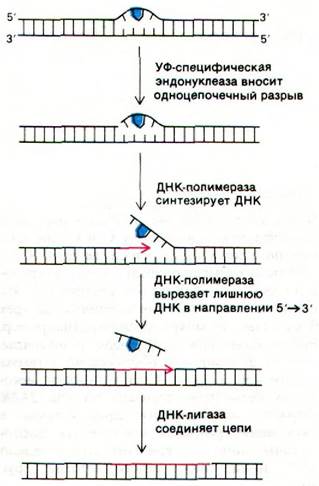
В осуществлении этого процесса важную роль играют четыре ферментативные активности (рис. 24.46). Первая из них - УФ-специфичная эндонуклеаза - находит место повреждения и вносит одноцепочечный разрыв вблизи от димера, обычно с 5'-стороны. Участок, содержащий димер, выпячивается из двойной спирали, что позволяет ДНК-полимеразе I (или другой подобной полимеразе) провести репарационный синтез в направлении 5' → 3'. Затравкой при этом служит 3'-конец разорванной цепи, а матрицей - интактная комплементарная цепь. Затем область, где расположен пиримидиновый димер, вырезается под действием 5' → 3'-нуклеазной активности ДНК-полимеразы. Наконец, новосинтезированная цепь и остаток той же цепи ДНК соединяются ДНК-лигазой. Другой путь репарации-фотохимическое расщепление пиримидинового димера. Почти все клетки содержат фотореактивирующий фермент, который узнает димер и расщепляет его на исходные основания, используя энергию поглощенного синего света.
Рис. 24.46. Репарация участка ДНК, содержащего тиминовый димер, в результате последовательного действия специфической эндонуклеазы, ДНК-полимеразы и ДНК-лигазы. Тиминовый димер показан синим цветом, а новосинтезированный участок ДНК - красным
24.25. Рак кожи при золотистой ксеродерме обусловлен нарушением нормальной репарации ДНК
Золотистая ксеродерма (Xeroderma pigmentosum) - редкое заболевание кожи у людей. Оно наследуется как аутосомный рецессивный признак. У гомозиготных больных кожа крайне чувствительна к солнечному и ультрафиолетовому свету. Серьезные поражения кожи наблюдаются уже в детстве, а с возрастом они принимают все более тяжелый характер. Кожа становится сухой, и дерма в значительной степени атрофируется. Появляются кератозы, веки покрываются рубцами, поражается роговица. Обычно во многих местах возникает рак кожи. Многие больные погибают, не достигнув 30 лет, от метастазов этих злокачественных опухолей кожи.
Ксеродерма - от греч. слов, означающих «сухая кожа». Этот термин был впервые использован F. Hebra и М. Kaposi в 1874 г. для описания «пергаментной кожи» и аномальной пигментации, наблюдавшихся у одного из больных.
В ДНК человека, как и у E. coli, под действием ультрафиолетового света образуются пиримидиновые димеры. Более того, механизмы репарации у человека и у E. coli, по-видимому, сходны. Изучение фибробластов кожи больных золотистой ксеродермой показало, что одна из форм этой болезни сопровождается биохимическим нарушением. В нормальных фибробластах половина пиримидиновых димеров, образовавшихся под действием ультрафиолетового облучения, вырезается менее чем за сутки. В фибробластах же, полученных от больных золотистой ксеродермой, за тот же промежуток времени вырезания димеров почти не наблюдается. Какой этап репарации нарушен? Ответ был получен путем определения молекулярной массы цепей ДНК из фибробластов, облученных ультрафиолетовым светом. В нормальных клетках в течение нескольких часов после облучения происходит заметное снижение молекулярной массы одноцепочечной ДНК. Это снижение молекулярной массы обусловлено первой реакцией процесса репарации, а именно расщеплением цепи ДНК рядом с пиримидиновым димером. После УФ-облучения клеток золотистой ксеродермы, наоборот, снижения молекулярной массы не происходит. Следовательно, это кожное заболевание, возможно, вызвано инактивацией эндонуклеазы, которая гидролизует остов ДНК рядом с пиримидиновым димером. Тяжелые клинические последствия этого ферментативного нарушения свидетельствуют об исключительной важности процессов репарации ДНК.