БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
ЧАСТЬ V. МОЛЕКУЛЯРНАЯ ФИЗИОЛОГИЯ
ГЛАВА 36. МЕМБРАННЫЙ ТРАНСПОРТ
36.12. Активный транспорт ряда сахаров сопряжен с их фосфорилированием
Симпорт - не единственный тип насосов, осуществляющих транспорт сахаров. У некоторых бактерий накопление углеводов происходит путем сопряжения их входа в клетку с фосфорилированием. Например, у многих бактерий поступающая в клетки глюкоза превращается в глюкозо-6-фосфат. Особенность транспорта этого типа, называемого транслокацией группы, состоит в том, что в ходе транспорта происходит модификация растворенного вещества. Клеточная мембрана непроницаема по отношению к фосфорилированным сахарам, и потому они накапливаются внутри бактериальной клетки.
Таблица 36.1. Углеводы, транспортируемые фосфо- трансферазной системой Е. coli

Наиболее хорошо изучен процесс транслокации групп, осуществляемый фосфо- трансферазной системой (ФТС) которую открыл Сол Роузман (Saul Roseman). Особенность этой системы состоит в том, что донором фосфорильной группы служит фос- фоенолпируват, а не АТР или какой-либо иной нуклеозидтрифосфат. Суммарная реакция, катализируемая фосфотрансферазной системой, следующая:

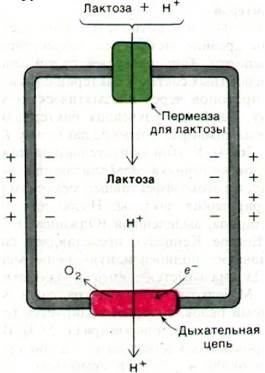
Рис. 36.15. Протонный градиент служит источником энергии для транспорта ряда сахаров и аминокислот в бактериальные клетки. Протонный градиент генерируется током электронов в дыхательной цепи
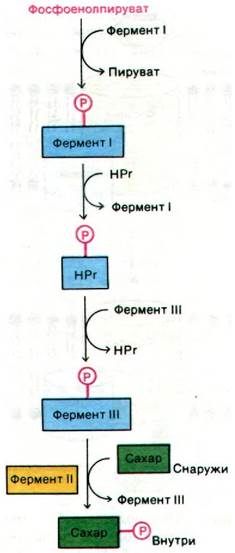
В этой транслокации участвуют 4 белка: HPг, фермент I, фермент II и фермент III. Фермент II, будучи интегральным белком мембраны, образует трансмембранный канал и катализирует фосфорилирование сахара. При этом фосфорильная группа фосфоенолпирувата переносится на сахар не прямо, а сначала на фермент I и после на специфический остаток гистидина небольшого термостабильного белка HPг (рис. 36.16). Образующийся в качестве промежуточного соединения фосфогистидин имеет высокий потенциал переноса фосфатной группы. промежуточный по величине между соответствующими значениями для АТР и фосфоенолпирувата. Далее происходит перенос фосфорильной группы от фосфорилированного HPг на фермент III - периферический мембранный белок, который уже взаимодействует с собственно каналом, т. е. ферментом II:
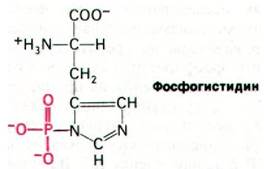
Рис. 36.16. Поток фосфорильных групп от фосфоенолпирувата на сахар, транспортируемый через мембрану фосфотрансферазной системой
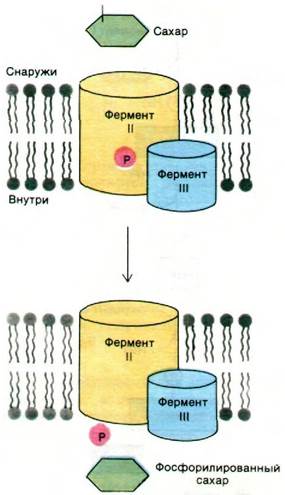
Конечный этап - перенос фосфорильной группы от фермента III на транспортируемый сахар (рис. 36.17). Из указанных четырех очищенных белков удалось реконструировать функционально активный ферментный комплекс.
Рис. 36.17. Предполагаемый механизм транслокации групп, осуществляемой фосфотрансферазной системой
Некоторые белки, входящие в состав фосфотрансферазной системы, обладают специфичностью, другие - нет. Так, HPг и фермент I, которые являются растворимыми белками цитозоля, участвуют в транспорте всех сахаров, переносимых этой системой. С другой стороны, ферменты II и III проявляют специфичность в отношении определенных сахаров. Например, в транспорте глюкозы, лактозы и фруктозы участвуют разные ферменты II и III. Такой же результат был получен и при генетических исследованиях. У мутантов, дефектных по HPг или ферменту I, не происходит транспорта большого числа разных сахаров, тогда как мутанты, дефектные по синтезу ферментов II и III, не способны транспортировать только какой-либо определенный сахар. Фермент III не участвует в транслокации гекситолов, в частности галактитола; в этом случае фосфорильная группа переносится непосредственно от HPг на углевод.
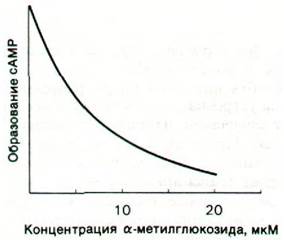
Чем объяснить, что фосфотрансферазная система устроена значительно сложнее других переносчиков, например, пермеазы для лактозы? Представляется вероятным, что фосфотрансферазная система не только осуществляет транспорт сахаров, но и выполняет регуляторные функции. Избыточное поступление какого-то одного углевода под действием фосфотрансферазной системы сильно подавляет активный транспорт сахаров другими переносчиками. Это ингибирование опосредуется, по-видимому, изменением содержания сАМР, а именно повышение концентрации сахара, накопленного фосфотрансферазной системой, ведет к снижению выработки сАМР (рис. 36.18). В результате прекращается транскрипция ряда индуцируемых оперонов. Вспомним, что экспрессия таких индуцируемых оперонов, как lac и gal, значительно возрастает при связывании комплекса сАМР с белком БАК в соответствующих участках промотора (разд. 28.6). Следовательно, фосфотрансферазная система регулирует использование источников углерода.
Рис. 36.18. Транспортируемый фосфотрансферазной системой сахар α-метилглюкозид ингибирует образование сАМР
36.13. Транспортные антибиотики повышают ионную проницаемость мембран
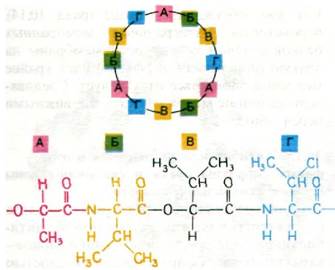
Ряд микроорганизмов синтезирует низкомолекулярные соединения, в присутствии которых мембраны становятся проницаемыми для определенных ионов. Эти небольшие молекулы, называемые транспортными антибиотиками, оказались ценным инструментом для экспериментальных исследований, в частности для изучения механизма связывания ионов. Например, валиномицин препятствует окислительному фосфорилированию в митохондриях путем повышения их проницаемости для К+: в присутствии валиномицина митохондрии используют энергию, генерируемую при транспорте электронов, не на синтез АТР, а на накопление К+. Валиномицин имеет циклическую структуру, образованную из повторяющейся три раза последовательности четырех разных остатков (А, Б, В и Г) (рис. 36.19). Эти остатки четырех типов соединены чередующимися эфирными и пептидными связями.
Рис. 36.19. Валиномицин имеет периодическую циклическую структуру, состоящую из остатков L-лактата (А), L-валина (Б), D-гидроксиизовалерианата (В) и D-валина (Г)
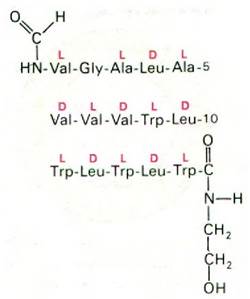
Еще один хорошо изученный транспортный антибиотик - грамицидин А (рис. 36.20). Это полипептид с открытой цепью, состоящий из 15 аминокислотных остатков. Примечательна структура грамицидина А: в нем чередуются D- и L-аминокислоты. Кроме того, N- и С-концы полипептида модифицированы. Как будет показано несколько ниже, транспорт ионов грамицидином А и валиномицином осуществляется совершенно по-разному.
Рис. 36.20. Структура грамицидина А
Механизм переноса ионов этими антибиотиками удобно исследовать на таких хорошо охарактеризованных модельных системах, как двуслойные липидные пузырьки (разд. 10.6) и плоские двуслойные мембраны (разд. 10.6). В опытах используют пузырьки, содержащие радиоактивный ион, например, 42К+; их получают путем обработки мембран ультразвуком в присутствии этого иона и последующего удаления 42К+, не попавшего внутрь пузырьков, методом гель-фильтрации. Далее сравнивают скорость выхода радиоактивного иона из пузырьков в присутствии и в отсутствие антибиотика. Другой способ получения информации относительно ионной проницаемости двуслойных мембран состоит в измерении таких электрических параметров, как сопротивление мембраны и мембранный потенциал. Например, сопротивление двуслойной мембраны по отношению к К+ в присутствии 10-7 М валиномицина или 10-9 М грамицидина падает более чем в 10000 раз при градиенте концентраций КCI на мембране 0,02 М.
36.14. Транспортные антибиотики функционируют либо как подвижные переносчики, либо как каналообразователи
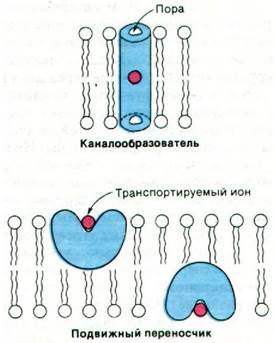
Существует два совершенно разных механизма действия транспортных антибиотиков на проницаемость мембран для ионов (рис. 36.21). Некоторые антибиотики (например, грамицидин А) формируют канал, пронизывающий мембрану. Ионы входят в такой канал на одной стороне мембраны, диффундируют по нему и выходят на другой стороне мембраны. Стимуляция транспорта ионов по этому механизму не сопряжена с движением самого антибиотика-ка- налообразователя. Антибиотики другой группы (например, валиномицин) функционируют как переносчики ионов через углеводородную область мембраны. Активность этих транспортных антибиотиков сопряжена с их собственной диффузией.
Рис. 36.21. Схематическое изображение различий между транспортными антибиотиками-канало- образователями и подвижными переносчиками. Все известные транспортные белки принадлежат к категории каналообразователей
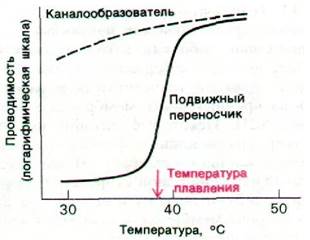
В эксперименте подвижные переносчики и каналообразователи можно различить следующим образом. Измеряют температурную зависимость ионной проводимости искусственной липидной двуслойной мембраны, содержащей транспортный антибиотик. При этом берут температурный интервал, включающий температуру фазового перехода липида; в этом интервале углеводородная середина мембраны переходит от практически затвердевшего состояния до совершенно жидкого. Каналообразователь, опосредуя транспорт ионов через мембрану, сам по себе не диффундирует. Следовательно, застывание углеводородного слоя не окажет существенного влияния на его способность транспортировать ионы. Иная ситуация складывается с подвижным переносчиком ионов, который для проявления активности должен диффундировать сквозь углеводородный слой мембраны: его эффективность при затвердении углеводородного слоя должна значительно уменьшиться. Данные экспериментов с валиномицином и грамицидином А действительно выявляют различие между двумя рассматриваемыми механизмами (рис. 36.22). Проницаемость содержащей валииомицин двуслойной мембраны возрастает при ее разжижении более чем в 1000 раз. В то же время на транспортную активность грамицидина А переход мембраны в жидкое состояние почти не оказывает влияния.
Рис. 36.22. Влияние температуры на проводимость липидных двуслойных мембран, одна из которых содержит транспортный антибиотик-каналообразова- тель, другая - транспортный антибиотик, являющийся подвижным переносчиком
Важно подчеркнуть, что все известные в настоящее время природные системы транспорта представляют собой каналы.
Как уже обсуждалось выше (разд. 10.14), перемещение интегральных мембранных белков с одной поверхности мембраны на другую (поперечная диффузия) идет крайне медленно либо вовсе отсутствует. Следовательно, они не могут служить подвижными переносчиками.