БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
ЧАСТЬ V. МОЛЕКУЛЯРНАЯ ФИЗИОЛОГИЯ
ГЛАВА 37. ВОЗБУДИМЫЕ МЕМБРАНЫ И СЕНСОРНЫЕ СИСТЕМЫ
37.14. Свет вызывает изомеризацию 11 -цис-ретиналя
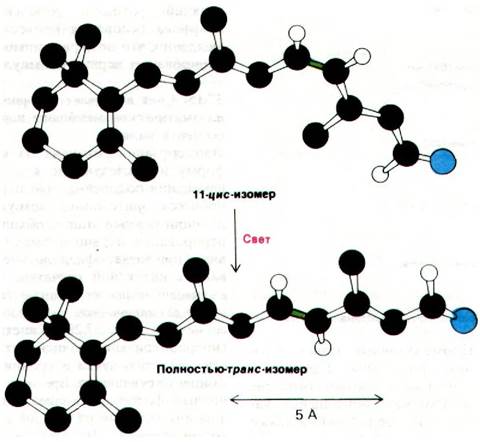
Первичный акт в процессе зрительного возбуждения известен. Как показал Джордж Уолд (George Wald), свет вызывает изомеризацию 11-цис-ретинальной группы родопсина в полностью-транс-ретиналь. В результате изомеризации сильно меняется геометрия ретиналя (рис. 37.27). Образованное ретина- лем шиффово основание передвигается по отношению к области кольца хромафора примерно на 5 А. В сущности, поглощенный фотон преобразуется в движение атомов.
Рис. 37.27. Первичный акт при возбуждении светом - это изомеризация 11-цис-изомера шиффова основания, образуемого ретиналем вполностью-транс-форму.
Двойная связь между С-11 и С-12 показана зеленым цветом
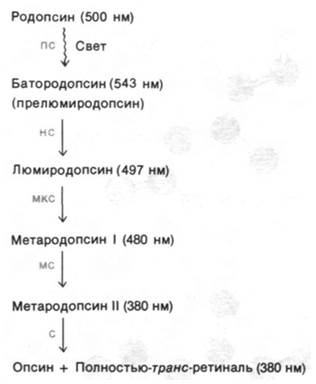
Значительная изомеризация ретиналя происходит практически в первые несколько пикосекунд после поглощения фотона, о чем можно судить по появлению новой полосы поглощения после сильного импульсного освещения лазером. Образующийся при этом промежуточный продукт фотолиза, называемый батородопсином (или прелюмиро- допсином), содержит напряженную полностью-транс-форму хромофора. Далее и решишь, и белок продолжает изменять свою конформацию, что приводит к образованию ряда промежуточных продуктов, различающихся по спектральным свойствам (рис. 37.28). При переходе от метародопсина I к метародопсину II, длящемуся около миллисекунды, происходит депротонирование шиффова основания. Лишенное протона шиффово основание в метародопсине II гидролизуется в течение примерно одной минуты с образованием опсина и полностью- транс-ретиналя; последний путем диффузии отделяется от опсина, поскольку не соответствует участку связывания 11-цис-изомера. Полностью-транс-ретиналь в темноте изомеризуется снова в 11-цис-ретиналь, который связывается с опсином, и таким путем регенерируется родопсин. В отличие от реакций фотолиза родопсина гидролиз шиффова основания протекает настолько медленно, что не играет никакой роли в генерировании нервного импульса.
Рис. 37.28. Промежуточные этапы фотолиза родопсина. Приведены длины волн, соответствующие максимумам поглощения каждого из соединений, а также постоянная времени каждого из превращений
37.15. Свет вызывает гиперполяризацию плазматической мембраны наружного сегмента палочек
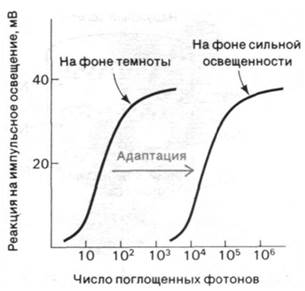
Изомеризация ретиналя из цис- в трансформу и последующие информационные изменения родопсина - это первичные акты процесса зрительного возбуждения. Следующий важный этап, необходимый для генерирования нервного импульса, был выявлен при электрофизиологических исследованиях интактной сетчатки. Квант света вызывает кратковременную гиперполяризацию плазматической мембраны наружных сегментов (рис. 37.29). Кинетика процесса гиперполяризации зависит от интенсивности светового пучка и уровня устойчивого фонового освещения. Время реакции на единичный фотон составляет около секунды, а на интенсивный падающий свет - несколько миллисекунд. В палочках не возникает потенциала действия. Их реакция на свет может быть различной силы. Величина сигнала, идущего от наружного сегмента к синапсу, зависит от числа поглощенных фотонов. Если взять обладающие полной чувствительностью адаптированные к темноте палочки, то полумаксимальный уровень гиперполяризации наблюдается при поглощении всего лишь 30 фотонов наружным сегментом палочки, содержащим 40 • 106 молекул родопсина (рис. 37.30). Поглощение единичного фотона адаптированной к темноте палочкой вызывает гиперполяризацию порядка 1 мВ, что улавливается синапсом и передается на другие нейроны сетчатки. Исключительная чувствительность - не единственное выдающееся свойство палочек. Их вторая поразительная особенность состоит в том, что реакция световоспринимающего аппарата фотодетектора на импульсное освещение зависит от уровня фоновой освещенности. Для возбуждения палочек, освещенных постоянным светом, требуется значительно больше фотонов, чем для палочек, находящихся в темноте (рис. 37.30). Благодаря этому свойству, называемому адаптацией, палочки сетчатки способны функционировать при уровнях фоновой освещенности, различающихся на много порядков величины.
Рис. 37.29. Под действием света происходит гиперполяризация палочек сетчатки
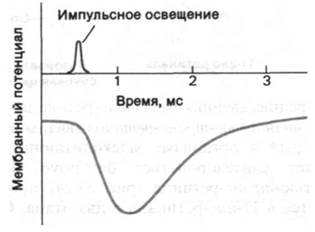
Рис. 37.30. Чувствительность палочек сетчатки к импульсному освещению зависит от фонового уровня освещенности
Каков ионный механизм индуцированной светом гиперполяризации? Плазматическая мембрана наружного сегмента палочки в темноте высоко проницаема для Na+. Это обстоятельство наряду с наличием высокого трансмембранного градиента концентраций Na+ приводит к тому, что в темноте ионы натрия быстро входят внутрь наружного сегмента. Этот градиент поддерживается (Na+ + К+)-АТРазой, локализованной в плазматической мембране внутреннего сегмента. Таким образом, в темноте ионы натрия входят в наружный сегмент, диффундируют далее во внутренний сегмент и затем выводятся с помощью насоса, работающего за счет энергии АТР. Свет каким-то образом блокирует Na+-каналы в плазматической мембране наружного сегмента. В результате ток Na+, направленный внутрь клетки, снижается и мембрана с внутренней стороны становится более электроотрицательной. Другими словами, мембранный потенциал палочек при освещении сдвигается в сторону равновесного К+-потенциала. Далее индуцированная светом гиперполяризация вблизи освещенных дисков пассивно передается по плазматической мембране на синаптическое тельце.
37.16. Медиаторы передают сигнал от фотолизированного родопсина на плазматическую мембрану
Изменение проницаемости плазматической мембраны для Na+ и последующая гиперполяризация - это многократно усиленные реакции наружного сегмента на свет. В самом деле, поглощение всего лишь одного фотона адаптированной к темноте палочкой блокирует ток более чем миллиона ионов натрия. Как возникает усиление такого масштаба? Прежде всего следует обратить внимание на то, что мембраны дисков, содержащие основную массу молекул родопсина, не соприкасаются с плазматической мембраной палочек и не сопряжены с ней электрически. Более того, молекула родопсина, поглотившая фотон, может быть удалена от натриевого канала плазматической мембраны на несколько тысяч ангстрем. Все это исключает возможность прямого взаимодействия между дисками и плазматической мембраной. Практически не может быть сомнений в том, что сигнал от фотолизированного родопсина (Рд*) в мембранах дисков передается на плазматическую мембрану с помощью диффундирующих медиаторов. При этом для обеспечения той высокой степени усиления, которая реально наблюдается, фотолиз одной молекулы родопсина должен сопровождаться образованием (или распадом) большого числа молекул медиатора.
Рис. 37.31. Схематическое изображение гипотезы о роли ионов кальция как медиаторов при зрительном возбуждении
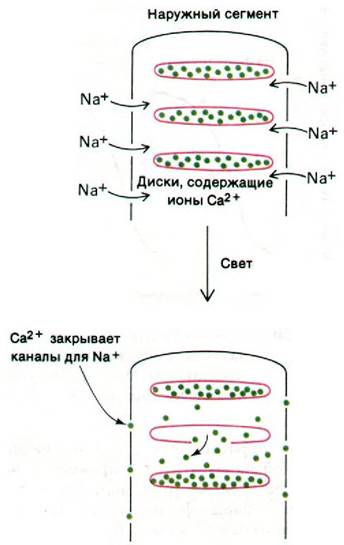
Природа медиатора не установлена еще окончательно; проведенные исследования позволили выдвинуть на эту роль двух достаточно вероятных кандидатов: ионы Са2+ (рис. 37.31) и циклический GMP (рис. 37.32). В пользу Са2+ как медиатора свидетельствуют следующие экспериментальные данные.
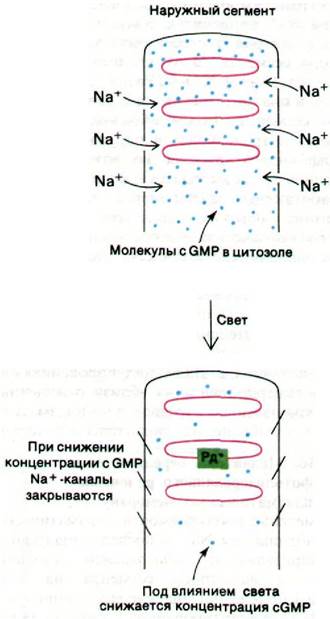
Рис. 37.32. Схематическое изображение гипотезы о роли cGMP как медиатора при зрительном возбуждении. Рд* - фотолизированный родопсин
1. Натриевые каналы в плазматической мембране закрываются при повышении содержания Са2+ в цитозоле и открываются при его понижении.
2. При введении в цитозоль хелатирующих агентов, специфически связывающих Са2+, чувствительность палочек к свету уменьшается. Такая десенсибилизация указывает на то, что фотолиз одной молекулы родопсина ведет к высвобождению в цитозоль нескольких сотен ионов Са2+.
3. После импульсного воздействия светом из наружных сегментов палочек выводится много Са2+.
Однако, судя по результатам других экспериментов, медиатором может быть cGMP. Решающее значение для этого заключения имеют следующие данные.
1. Натриевые каналы плазматической мембраны открываются при повышении содержания cGMP в цитозоле и закрываются при снижении содержания этого нуклеоти
да.
2. Содержание cGMP регулируется светом. В частности, под действием света происходит активация фосфодиэстеразы, гидролизующей cGMP, что будет описано несколько ниже.
3. Фотолиз одной молекулы родопсина ведет к быстрому гидролизу 105 молекул cGMP.