БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
ЧАСТЬ V. МОЛЕКУЛЯРНАЯ ФИЗИОЛОГИЯ
ГЛАВА 37. ВОЗБУДИМЫЕ МЕМБРАНЫ И СЕНСОРНЫЕ СИСТЕМЫ
37.20. Хеморецепторы бактерий воспринимают специфические молекулы и передают сигналы на жгутики
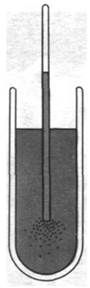
В конце XIX в. немецкий ботаник Вильгельм Пфеффер (Wilhelm Pfeffer) продемонстрировал, что подвижные бактерии скапливаются вокруг отверстия тонкого капилляра, содержащего какой-нибудь аттрактант, например, сахар (рис. 37.38). В случае же, когда капилляр содержит репеллент (обычно это вещество, повреждающее бактерии, или продукт их выделения), бактерии движутся прочь от капилляра. Такое направленное движение бактерий в сторону одних веществ и прочь от других называется хемотаксисом. В 60-х годах Джулиус Адлер (Julius Adler) начал изучать молекулярную основу хемотаксиса бактерий. Выполненные им, а также большим числом других ученых биохимические, генетические и структурные исследования раскрыли многие стороны этого процесса. Хемотаксис начинается с обнаружения химических соединений специфическими хеморецепторами на поверхности клетки. Информация от этих сенсоров передается в систему преобразования, где происходит анализ и интеграция большого числа стимулов. Далее сенсорная преобразующая система посылает сигналы к моторам, приводящим в движение жгутики. В зависимости от этих сигналов бактерия либо плавно передвигается по прямой, либо резко меняет направление движения.
Рис. 37.38. Хемотаксис у бактерий. Бактерии движутся к капилляру, содержащему атрактант, например, глюкозу
У Е. coli обнаружено около 20 различных хеморецепторов. Каждый из этих белков локализован или в плазматической мембране, или в периплазматическом пространстве. Хеморецептор содержит узнающий и сигнализирующий компоненты. В хеморецепторах, обеспечивающих положительный хемотаксис (привлечение), узнающий компонент оказался связывающим белком, участвующим в транспорте данного соединения в клетку. Так, например, связывающий галактозу белок (растворимый белок, локализованный в периплазматическом пространстве) служит и узнающим компонентом при положительном хемотаксисе на галактозу, и частью насоса, осуществляющего активный транспорт галактозы в клетку. Хеморецептор для глюкозы является также компонентом фосфотрансферазной системы, связанной с мембраной и обеспечивающей активное потребление этого сахара (разд. 36.12). На поверхности Е. coli имеются хеморецепторы и для таких аттрактантов, как серин, цистеин, аланин, глицин. Хотя транспорт и хемотаксис тесно связаны между собой, однако хемотаксис не зависит от процессов транспорта. Так, некоторые мутанты, неспособные транспортировать определенные сахара или аминокислоты, сохраняют способность направленно двигаться к ним. Имеются также различные хеморецепторы, связанные с отрицательным хемотаксисом. Жирные кислоты, спирты, гидрофобные аминокислоты, индол, Н+ (рН < 6,5), ОН- (рН > 7,5) и сульфиды отталкивают бактерии путем взаимодействия со специфическими хемосенсорами.
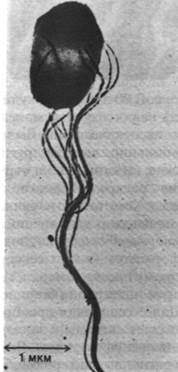
Рис. 37.39. Электронная микрофотография S. typhimurium. Хорошо видно, что жгутики собраны в пучок
37.21. В основании бактериального жгутика находится вращающий его реверсивный «мотор»
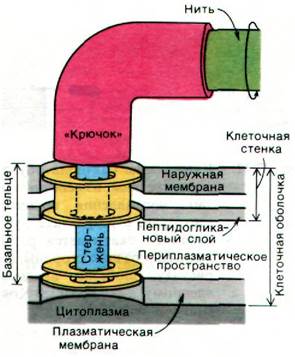
Бактерии плывут благодаря вращению жгутиков, отходящих от поверхности клетки. Эти тонкие спиральные нити состоят из субъединиц массой 53 кДа, называемых флагеллином. У бактерии Е. coli имеется около 6 жгутиков длиной 10 мкм и диаметром 150 А. Жгутики бактерий по сравнению со жгутиками и ресничками эукариот (разд. 34.18) имеют значительно меньшие размеры и проще устроены. Бактериальный жгутик сам по себе не может совершать активных волнообразных движений, так как в нем нет сократительного аппарата. Его вращает «мотор», расположенный в участке соединения жгутика с клеточной оболочкой. Выделение жгутиков, сохраняющих прикрепленную к ним базальную структуру, позволило изучить эти образования; оказалось, что они состоят из нити, крючка и стержня. У E. coli на стержень насажены 4 кольца. Наружное кольцо прикреплено к наружной мембране, а внутреннее - к плазматической мембране клеточной оболочки. Базальное тельце (рис. 37.40) заякоривает жгутик к клеточной оболочке и приводит его в движение. Этот «мотор» работает за счет протонодвижущей силы, возникающей на плазматической мембране, а не за счет энергии гидролиза АТР. Действительно, угловая скорость вращения прямо пропорциональна протонодвижущей силе. Загадочное свойство «мотора» состоит в том, что он может вращаться как по часовой стрелке, так и против нее.
Рис. 37.40. Базальное тельце жгутика у Е. coli
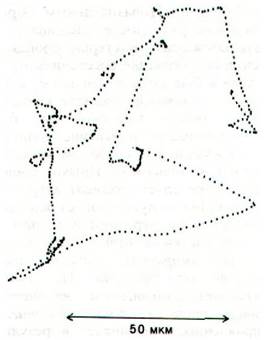
Обычно отдельная бактерия Е. coli спокойно плывет по прямой примерно одну секунду. За это время она проходит расстояние около 30 мкм, что примерно в 15 раз превышает ее собственную длину. Затем бактерия как бы кувыркается и резко меняет направление движения (рис. 37.41). Угол поворота в среднем обычно составляет 60°. От чего зависит, движется ли бактерия плавно или кувыркаясь? Оказалось, что при вращении жгутиков против часовой стрелки их спиральные нити организуются в стройный пучок, который и обеспечивает плавное передвижение клетки. Если же жгутики вращаются по часовой стрелке, то весь пучок рассыпается, каждая нить тянет в свою сторону и бактерия начинает кувыркаться.
Рис. 37.41. Проекция пути E. coli, полученная в электронном микроскопе путем автоматического слежения за перемещением бактерии в трех измерениях. Точки отделены друг от друга промежутком 80 мс
37.22. Бактерии различают временной градиент, а не одномоментный пространственный градиент концентраций
Регуляция частоты кувыркания занимает центральное место в хемотаксисе. Когда бактерия движется в направлении увеличения концентрации аттрактанта, кувыркание становится реже. Наоборот, при движении от аттрактанта бактерия кувыркается чаще. Репелленты оказывают противоположный эффект на частоту кувыркания бактерий. В результате при движении в сторону аттрактанта или прочь от репеллента бактерия плывет прямолинейно в течение большего промежутка времени, чем при движении в противоположном направлении. Кувыркание способствует выбору правильного направления.
Рис. 37.42. Кувыркание бактерии обусловлено резким изменением на 180° направления вращения «мотора»; в результате пучок жгутиков оказывается разметанным в разные стороны
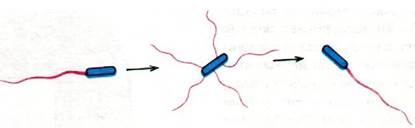
Сравнивает ли бактерия концентрации аттрактанта на двух концах своей клетки, или же она сравнивает концентрации аттрактанта в два отдельных момента времени? Другими словами, является ли ее сенсорный механизм пространственным или временным? Дэниел Кошланд и Роберт Макнаб (Daniel Koshland, Robert Macnab) нашли ответ на этот важный вопрос, поставив очень простой и остроумный опыт. Суспензию бактерий в среде, лишенной аттрактанта, быстро смешивали с раствором, содержащим аттрактант, и подсчитывали частоту кувырканий бактерий. Поразительным образом уже через секунду после смешивания эта частота снижалась. Бактерии проплывали относительно большие расстояния по прямой, хотя в быстро перемешанном растворе пространственный градиент концентрации отсутствовал. Следовательно, бактерии воспринимают изменение концентрации во времени, т.е. обладают временным сенсорным механизмом. Иными словами, бактерия определяет градиент аттрактанта в пространстве не путем сопоставления его концентрации на переднем и заднем концах своей клетки, а путем сопоставления отдельных восприятий концентрации во времени по мере движения. По существу, бактериальный хемотраксис - это частично ориентированное случайное движение. Целенаправленность возникает в результате отбора случайных направлений движения.
37.23. При бактериальном хемотаксисе передача информации обеспечивается метилированными белками
Реакция бактерии на тот или иной градиент концентрации аттрактанта не является строго определенной. Торможение кувыркания, обусловленное повыше-
нием концентрации аттрактанта, является временным. После определенного лаг-периода частота кувырканий возвращается к исходному уровню. По существу, при постоянном наличии аттрактанта бактерия теряет чувствительность к нему. Благодаря такой десенсибилизации, называемой адаптацией, бактерии способны воспринимать градиенты в широком диапазоне концентраций аттрактанта. Как указывалось ранее, аналогичным свойством обладает реакция палочек сетчатки на свет (рис. 37.30).
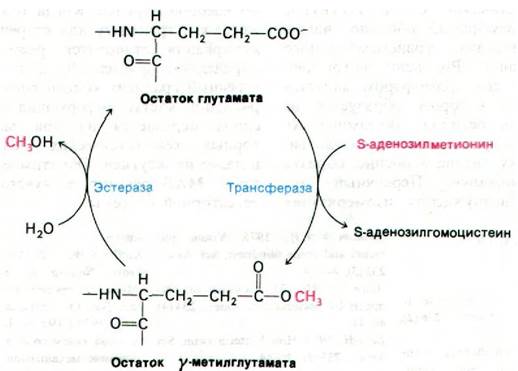
Генетические исследования хемотаксиса бактерий показали, что информация по крайней мере от 12 хеморецепторов передается через 3 белка-продукта генов tsr, tar и trg (рис. 37.43). Например, сигналы от рецепторов рибозы и галактозы поступают на белок trg. Указанные три белка подвергаются обратимому метилированию, и потому их называют метил-акцепторные хемотаксические белки (МХБ). Несколько глутаматных боковых цепей в каждом из этих белков подвергается метилированию под действием метилтрансферазы, использующей S-аденозилметионин в качестве активированного донора метильных групп (рис. 37.44). Эти ковалентные модификации могут быть обращены специфической эстеразой. Уровень метилирования МХБ возрастает при воздействии аттрактантом и снижается при воздействии репеллентом. По-видимому, адаптация опосредована степенью метилирования этих белков.
Рис. 37.43. Путь передачи информации при хемотаксисе бактерий. В нижней части схемы показаны выявленные типы мутантов. МХБ - акцептирующий метильную группу хемотаксический белок
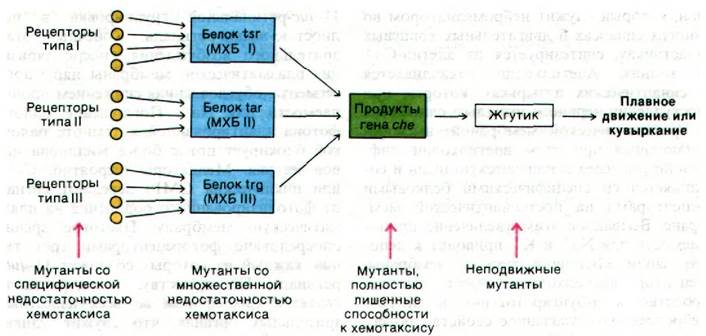
Рис. 37.44. Обратимое метилирование метил-акцепторных хемотаксических белков
Информация от указанных трех метилакцепторных белков попадает далее на продукты генов che. Каким образом эти молекулы определяют направление вращения жгутиков, остается неизвестным. Однако теперь уже совершенно ясно, что у бактерий имеется примитивная сенсорная система, образованная продуктами примерно 30 генов, в которой обрабатывается и интегрируется информация относительно питательных веществ и ядов в окружающей бактерию среде. В сущности, основной вопрос для бактерии: «кувыркаться или не кувыркаться»?