БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
Часть IV ИНФОРМАЦИЯ
ГЛАВА 29. ЭУКАРИОТИЧЕСКИЕ ХРОМОСОМЫ И ВЫРАЖЕНИЕ ГЕНОВ У ЭУКАРИОТ
29.23. Ферменты сплайсинга с высокой точностью удаляют нитроны из первичных транскриптов разорванных генов
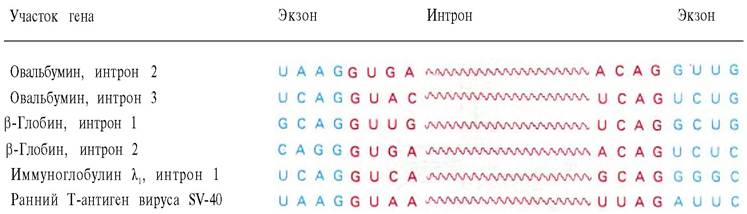
При сплайсинге (расщепление с последующим сращиванием) мРНК происходит разрыв двух фосфодиэфирных связей и образование одной новой. Эндонуклеазная и лигазная активности, вероятно, содержатся в одном ферментном комплексе, и последовательные реакции сплайсинга согласованы между собой. В настоящее время многие лаборатории пытаются выделить ферменты сплайсинга. Очевидно, их действие должно обладать высокой точностью. Ошибка в точке сплайсинга на один нуклеотид приведет к сдвигу рамки считывания в сторону 3'-конца от этого места, что даст совершенно иную последовательность аминокислот. Как ферменты сплайсинга узнают свои мишени? В настоящее время известен ряд нуклеотидных последовательностей в месте стыка экзонов и интронов, кодирующих РНК-транскрипты (табл. 29.7). В этих последовательностях есть общий мотив: интрон начинается с GU и кончается AG. Следует отметить, что один и тот же сигнал сплайсинга встречается у кур, кроликов, мышей и в ДНК вируса SV-40, который заражает клетки обезьян и человека.
Таблица 29.7. Последовательности оснований транскриптов, содержащих нитроны, вблизи участков сплайсинга
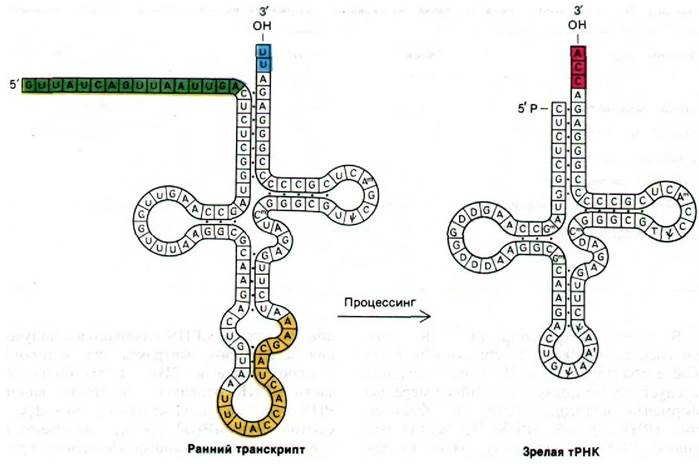
В молекулах транспортной РНК точки сплайсинга окружены совершенно другими последовательностями. Из этого, очевидно, следует, что существует по крайней мере два фермента сплайсинга: один для образования мРНК, другой - тРНК. Процесс сплайсинга тРНК, по-видимому, очень сходен у эволюционно далеких видов. Клонированные гены одной из дрожжевых тРНК вводили в ооциты Xenopus с помощью микроинъекции для того, чтобы выяснить, может ли ген одноклеточного эукариота транскрибироваться, а его продукт - процессироваться в клетке амфибии. Самое поразительное, что в клетке Xenopus происходят транскрипция дрожжевого гена и правильный процессинг его продукта, несмотря на то что гены этой тРНК у двух видов совершенно различны. В частности, 14-нуклеотидная вставочная последовательность правильно удаляется (рис. 29.33). Итак, специфичность ферментов сплайсинга сохранилась на протяжении огромного периода эволюции.
Рис. 29.33. Процессинг предшественника дрожжевой тирозиновой тРНК. Происходит удаление 14-нуклеотидной вставочной последовательности (показано желтым цветом), и ряд оснований модифицируется. Продукт длиной 92 нуклеотида получается из первичного транскрипта длиной 108 нуклеотидов путем отщепления 5'-концевой лидерной последовательности и присоединения ССА к 3'-концу
29.24. В настоящее время известны последовательности оснований многих информационных РНК
Многие эукариотические мРНК были выделены в очищенном виде. У некоторых из них была определена последовательность оснований. Выделение какой-либо мРНК начинается с выбора клеток, в которых она содержится в большом количестве. Например, ретикулоциты богаты глобиновой мРНК, яйцеводы кур - мРНК овальбумина, плазматические клетки - мРНК иммуноглобулинов, эмбрионы морского ежа - мРНК гистонов. Выделение мРНК начинается с получения клеточного экстракта, из которого удаляют белки и ДНК. Затем большую часть мРНК отделяют oт других видов РНК, используя наличие в них poly(А)-фрагментов. Эти мРНК прочно связываются с колонками, содержащими ковалентно привязанные полинуклеотиды poly(U) и poly(Т). После элюции с такой аффинной колонки мРНК ее можно фракционировать по размеру молекул методом гель-электрофореза или седиментации. Другой способ выделения индивидуальной мРНК - иммунопреципитация. Например, если добавить в белоксинтезирующий экстракт антитела, специфичные к овальбумину, это переведет в осадок полисомы, содержащие овальбуминовую мРНК. Для того чтобы проверить препарат мРНК, его добавляют в бесклеточную систему синтеза белка, которая работает только в присутствии экзогенной РНК. Для этого часто используются экстракты проростков пшеницы.
Наличие очищенных индивидуальных мРНК открывает возможности для ряда интересных экспериментов. Во-первых, с помощью метода гибридизации, соответствующей мРНК (или комплементарной ей ДНК-копии) с хромосомной ДНК можно определить число определенных генов в геноме. Во-вторых, можно идентифицировать фрагменты ДНК, содержащие данный ген, гибридизуя их с мРНК. Затем эти фрагменты можно клонировать (разд. 31.11), чтобы получить сам ген и прилегающие к нему участки хромосомы в большом количестве. В-третьих, с помощью электронной микроскопии можно выявить вставочные последовательности в этом гене (разд. 26.12). В-четвертых, можно определить последовательность нуклеотидов мРНК, чтобы идентифицировать регуляторные сигналы.
Недавно была определена последовательность овальбуминовой мРНК. Эта мРНК содержит 1859 нуклеотидов на участке от «колпачка» на 5'-конце до poly(A) на 3-конце (рис. 29.34). 1158 нуклеотидов, кодирующих белок, обрамлены с обеих сторон нетранслируемыми последовательностями. С 5'-стороны она короче, чем с 3'-стороны. Нетранслируемый 5'-концевой участок длиной 64 нуклеотида содержит «колпачок», инициирующий кодон AUG, взаимодействует с белоксинтезирующим аппаратом и участвует в инициации синтеза белка. Весьма многозначителен тот факт, что этот участок содержит последовательность, комплементарную 3'-концу 18S-pPHK. Напомним, что у прокариот инициирующая последовательность в мРНК спаривается с 3'-концом 16S-pPHK (разд. 27.14). Роль очень длинной нетранслируемой последовательности, расположенной с 3'-стороны, неизвестна. Для этого участка длиной 637 нуклеотидов характерно обилие коротких повторяющихся последовательностей. Фрагменту poly(Á) в овальбуминовой мРНК, как и в других мРНК, предшествует GC, а примерно за 20 нуклеотидов до этого - AAUAAA.
Рис. 29.34. Схема организации овальбуминовой мРНК курицы

29.25. Эукариотическая рибосома (80S) состоит из малой (40S) и большой (60S) субчастиц
Аппарат синтеза белка у эукариот аналогичен соответствующему аппарату у прокариот, но составляющие его белки и РНК отличаются от прокариотических и, кроме того, они содержатся в большем количестве. Цитоплазматические рибосомы эукариотических клеток несколько крупнее, чем рибосомы бактерий. Эукариотические рибосомы (рис. 29.35) имеют коэффициент седиментации 80S, а не 70S. Подобно бактериальным рибосомам, они диссоциируют на большую (60S) и малую (40S) субчастицы. 40S-субчастица содержит молекулу 18S-PHK и примерно 30 белков. Остальные три рибосомные PHK - 5S, 5,8S и 28S - локализованы в 60S-субчастице, в которую входит также примерно 45 белков.
Рис. 29.35. Электронная микрофотография эукариотических 80S рибосом

Стадии трансляции - инициация, элонгация и терминация - в основном сходны у эукариот и прокариот. Однако в некоторых частностях механизмы реакции различаются. Так, эукариоты используют для инициации особую тРНК (она называется тРИКМ«Met), но она у них не формилируется. Эукариоты и прокариоты различаются также по чувствительности к некоторым ингибиторам трансляции. Циклогексимид ингибирует элонгацию только у эукариот, тогда как эритромицин блокирует эту же стадию только у прокариот. Любопытно отметить, что рибосомы митохондрий и хлоропластов имеют больше общего с бактериальными рибосомами, чем с рибосомами окружающего их цитозоля. Кроме того, в митохондриях и хлоропластах используется формилированная инициаторная тРНК, а их рибосомы чувствительны к большинству ингибиторов, избирательно блокирующих трансляцию у прокариот.
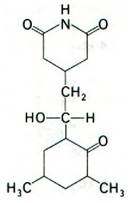
Рис. 29.36. Структура циклогексимида - ингибитора стадии элонгации синтеза белка у эукариот, но не у прокариот