БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
Часть IV ИНФОРМАЦИЯ
ГЛАВА 24 ДНК: ГЕНЕТИЧЕСКАЯ РОЛЬ, СТРУКТУРА И РЕПЛИКАЦИЯ
24.10. Некоторые молекулы ДНК имеют кольцевую форму
Методом электронной микроскопии было показано, что интактные молекулы ДНК из многих источников замкнуты в кольцо (рис. 24.18). Открытие того факта, что Е. coli имеет кольцевую хромосому, не было неожиданностью. Оно было предсказано на основе генетических исследований, показавших, что карта генетического сцепления этой бактерии является кольцевой. Термин «кольцевая» означает лишь, что цепь ДНК непрерывна, и отнюдь не относится к ее геометрической форме. In vivo молекулы ДНК всегда имеют весьма компактную форму. В связи с этим следует отметить, что хромосома Е. coli примерно в 1000 раз длиннее, чем клетка бактерии.
Не все молекулы ДНК имеют кольцевую форму. Например, ДНК бактериофага Т7 является линейной. Молекулы ДНК некоторых вирусов, таких, как бактериофаг ![]() , претерпевают взаимопревращения линейной и кольцевой форм. В вирусной частице присутствует линейная форма, а в клетке-хозяине - кольцевая (разд. 30.16).
, претерпевают взаимопревращения линейной и кольцевой форм. В вирусной частице присутствует линейная форма, а в клетке-хозяине - кольцевая (разд. 30.16).
24.11. Кольцевые двухспиральные молекулы ДНК могут находиться в суперспирализованном состоянии
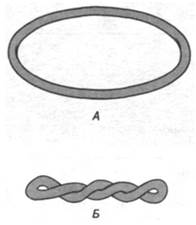
При превращении линейной двухцепочечной ДНК в замкнутую кольцевую молекулу она приобретает новое свойство. Джером Виноград (Jerome Vinograd) установил, что ось двойной спирали ДНК может сама быть закручена в суперспираль. Эта суперспираль может быть закручена в правую или в левую сторону (рис. 24.22). Термины «суперспирализованная», «сверхскрученная», «суперспиральная», «суперскрученная» и «сверхспиральная» - синонимы. Кольцевую ДНК, совершенно лишенную суперспиральных витков, называют релаксированной. Для того чтобы превратить релаксированную ДНК в суперспирализованную, необходимо затратить определенную энергию. Например, энергия, затрачиваемая на образование 15 суперспиральных витков в одной молекуле ДНК вируса SV-40 (ее контурная длина 1,7 мкм), составляет около 100 ккал/моль. Энергия напряжения суперспирализованной ДНК (энергия суперспирализации) примерно пропорциональна квадрату числа суперспиральных витков.
Рис. 24.22. Схематическое изображение релаксированной (А) и суперспирализованной (Б) ДНК
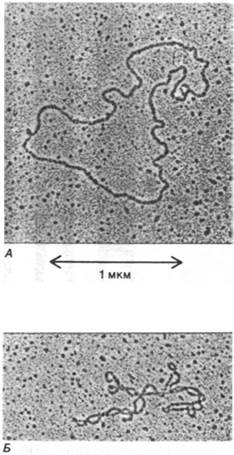
Суперспирализация, по-видимому, выполняет две биологические функции. Во- первых, суперспирализованная ДНК имеет более компактную форму, чем релаксированная ДНК такой же длины (рис. 24.23). Суперспирализация может играть определенную роль в упаковке ДНК. Во-вторых, Суперспирализация может влиять на степень расплетания двойной спирали и, следовательно, на ее взаимодействия с другими молекулами. Точнее, отрицательная суперспирализация может приводить к раскручиванию двойной спирали. Интересно отметить, что почти все кольцевые молекулы ДНК, встречающиеся в природе, отрицательно суперспирализованы.
Рис. 24.23. Электронные микрофотографии митохондриальной ДНК: А -релаксированная кольцевая форма; Б - суперспирализованная кольцевая форма
Важная характеристика замкнутой кольцевой ДНК - ее порядок зацепления L (от англ. linking). Число L указывает, сколько раз одна цепь пересекает другую цепь, если их спроецировать на плоскость. Число L должно быть целым. Кручение Т (от англ. twisting) и величина суперспирализации W (от англ. writhe) связаны между собой уравнением
L= W + Т, т.е. находятся в обратной зависимости.
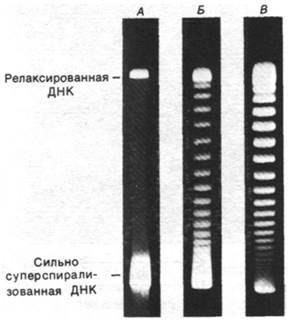
Порядок зацепления - топологическая характеристика; она может изменяться, лишь когда в одну или в обе цепи кольцевой ДНК вносятся разрывы. Действительно, были выделены ферменты, которые каталитически изменяют величину L. Каталитическую активность таких топоизомераз легко выявить с помощью гель-электрофореза, так как суперспирализованная ДНК более компактна и поэтому имеет большую подвижность, чем релаксированная ДНК (рис. 24.24).
Рис. 24.24. Фотографии гелей, на которых видна релаксация суперспирализованной ДНК вируса SV-40. Дорожка А - суперспирализованная ДНК с большим числом отрицательных витков. При инкубации ДНК с топоизомеразой в течение 5 мин (Б) и 30 мин (В) образуется ряд полос с более низкой степенью суперспирализации
24.12. Открытие ДНК-полимеразы
Перейдем теперь к молекулярному механизму репликации ДНК. Артур Корнберг (Arthur Kornberg) и его коллеги в 1955 г. начали поиск фермента, синтезирующего ДНК. Вскоре этот поиск увенчался успехом, главным образом потому, что при планировании экспериментов были приняты три правильных решения, т.е. был сделан правильный выбор между несколькими возможностями.
1. Что представляют собой активированные предшественники ДНК? Корнберг и его коллеги сделали правильное предположение, что активированные промежуточные продукты синтеза ДНК - дезоксирибонуклеозид-5'-трифосфаты. В основе этого предположения лежали два соображения. Во-первых, пути биосинтеза пуринов и пиримидинов приводят к образованию нуклеозид-5'-фосфатов (а не нуклеозид-3'- фосфатов). Во-вторых, активированным промежуточным продуктом синтеза пирофосфатной связи в таких коферментах, как NAD+, FAD и СоА, является АТР.
2. Что может служить критерием синтеза ДНК? Предполагалось, что абсолютное количество ДНК, синтезированной в первоначальных экспериментах, должно быть весьма невелико, главным образом из-за обилия нуклеаз. Поэтому нужен был какой-то чувствительный тест. Был разработан такой тест с использованием радиоактивныхнуклеотидов-предшественников.
Включение этих предшественников в ДНК обнаруживали путем измерения радиоактивности в осадке, полученном после обработки инкубационной смеси кислотой. В основе этого метода лежит тот факт, что ДНК осаждается кислотами, например, трихлоруксусной кислотой, а нуклеотиды - предшественники остаются в растворе.
3. Какие клетки следует выбрать для исследования? После того как первоначальные эксперименты с экстрактами животных клеток дали отрицательные результаты, выбор пал на бактерии Е. coli, поскольку деление этих клеток происходит всего лишь за 20 мин (время генерации), и, следовательно, их можно выращивать в больших количествах. Как и предполагалось, эта бактерия исключительно богата ферментами, участвующими в синтезе ДНК.
Экстракт Е. coli инкубировали с радиоактивным дезокситимидин-5'-трифосфатом. Радиоактивность этого 14С-меченного предшественника составляла 1 • 106 имп/мин. Радиоактивность осадка, полученного добавлением к инкубационной смеси кислоты, составляла всего 50 имп/мин. Было синтезировано лишь несколько пикомолей ДНК, но этим было положено начало. Корнберг писал: «Хотя количество нуклеотида, включившегося в состав нуклеиновой кислоты, было ничтожным, оно было существенно выше уровня фона. Мы попробовали забить клин в эту узенькую щелку. Молотком нам служила очистка фермента - метод, отработанный при изучении спиртового брожения».
Этот новый фермент был назван ДНК- полимеразой (рис. 24.25). Теперь его называют ДНК-полимеразои I, так как с тех пор были выделены другие ДНК-полимеразы. После десяти лет напряженной работы в лаборатории Корнберга ДНК-полимераза I была очищена до гомогенного состояния и детально охарактеризована. Насколько велики были масштабы проделанной работы, говорит тот факт, что для получения 500 мг чистого фермента необходимо было взять 100 кг клеток E. coli.
Рис. 24.25. Электронная микрофотография молекул ДНК-полимеразы (сферические структуры), связанных с молекулой ДНК (тонкая нить)
ДНК-полимераза I - это единая полипептидная цепь с массой 109 кДа. Она катализирует последовательное присоединение дезоксирибонуклеиновых звеньев к цепи ДНК:
![]()
Для синтеза цепи ДНК ДНК-полимеразе I необходимы следующие компоненты:
1. В среде должны присутствовать все четыре дезоксирибонуклеозид-5'-трифосфата: dATP, dGTP, dTTP и dСТP. В дальнейшем мы будем обозначать эти дезоксири- бонуклеозидтрифосфаты общим символом dNTP. Кроме того, необходимы ионы Мg2+.
2. ДНК-полимераза I присоединяет дезоксирибонуклеотиды к З'-гидроксильному концу предсуществующей цепи ДНК (или РНК). Другими словами, необходима затравочная цепь, или затравка, со свободной З'-гидроксильной группой.
3. Необходима матричная ДНК. Матрицей может служить как одно- так и двухцепочечная ДНК. Двухцепочечная ДНК служит эффективной матрицей лишь в том случае, если ее сахарофосфатный остов разорван в одном или нескольких местах.
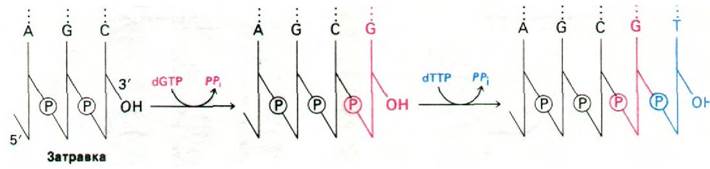
Реакция элонгации (удлинения) цепи, катализируемая ДНК-полимеразой, происходит путем нуклеофильной атаки 3'-ОН-концом матрицы ближайшего к рибозе атома фосфора очередного дезоксирибонуклеозид- трифосфата. В результате образуется фосфодиэфирный мостик и одновременно высвобождается пирофосфат (рис. 24.26). Последующий гидролиз пирофосфата обеспечивает дальнейшую полимеризацию. Такое смещение общего состояния равновесия было бы невозможно, если бы активированными промежуточными продуктами служили нуклеозиддифосфаты. Именно в этом мы усматриваем убедительную причину преобладания нуклеозидтрифос- фатов по сравнению с дифосфатами в качестве активированных предшественников в биосинтетических реакциях. Элонгация цепи ДНК происходит в направлении 5' → 3' (рис. 24.27). За секунду одна молекула ДНК-полимеразы I присоединяет примерно 10 нуклеотидов. Полимеризация процес- сивна, т. е. фермент присоединяет много нуклеотидов, оставаясь связанным с одной матрицей.
Рис. 24.26. Реакция элонгации цепи, катализируемая ДНК-полимеразой
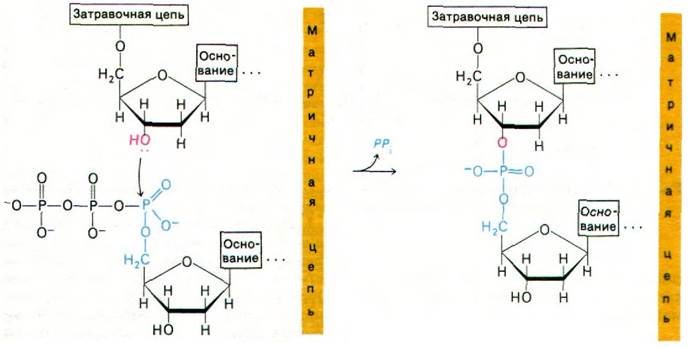
Рис. 24.27. ДНК -полимеразы катализируют рост цепей ДНК в направлении 5' → 3'