БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
Часть IV ИНФОРМАЦИЯ
ГЛАВА 24 ДНК: ГЕНЕТИЧЕСКАЯ РОЛЬ, СТРУКТУРА И РЕПЛИКАЦИЯ
24.13. ДНК-полимераза получает инструкции от матрицы
ДНК-лолимераза катализирует образование фосфодиэфирной связи только в том случае, если основание очередного нуклеотида комплементарно соответствующему основанию матричной цепи. Если же основание очередного нуклеотида не образует уотсон-криковской пары с соответствующим основанием матричной цепи, вероятность образования ковалентной связи очень низка. Следовательно, ДНК-полимераза - фермент, направляемый матрицей. Она была открыта первой из ферментов такого типа.
Ряд экспериментов доказывает, что ДНК- полимераза получает инструкции от матрицы.
1. Первым доводом в пользу этого утверждения послужил тот факт, что значительный синтез ДНК идет только в присутствии всех четырех дезоксирибонуклео- зидтрифосфатов и матричной ДНК,
2. ДНК-полимераза может включать в ДНК некоторые аналоги оснований. Например, урацил или 5-бромурацил может замещать тимин. Гипоксантин может замещать гуанин. Способность аналогов замещать основания высоко специфична. Согласно правилу замещения, тот или иной аналог может включаться лишь при условии, что он способен образовать уотсон- криковскую пару с основанием, комплементарным замещаемому основанию. Так, гипоксантин может замещать в (но не А, Т и С), поскольку он образует подходящую пару оснований с цитозином.
3. Нуклеотидный состав новосинтезированной ДНК зависит от характера матрицы, а не от относительного количества четырех нуклеотидов-предшественников. Образующаяся ДНК имеет тот же нуклеотидный состав, что и двухспиральная матричная ДНК. Из этого следует, что под действием ДНК-полимеразы реплицируются обе цепи матричной ДНК.
4. Наиболее убедительным доводом служат данные о том, что ДНК фага ɸХ174, реплицированная in vitro ДНК-полимеразой I, полностью инфекционна. Следовательно, частота, с которой этот фермент делает ошибки, очень низка.
24.14. ДНК-полимераза I исправляет ошибки в ДНК
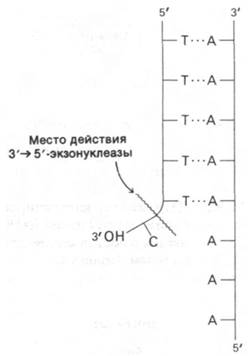
ДНК-полимераза обладает еще одним видом ферментативной активности: в определенных условиях она способна расщеплять цепи ДНК. ДНК-полимераза постепенно гидролизует цепь ДНК с З'-гидроксильного конца. При этом отщепляются мононуклеотиды. Таким образом, ДНК-полимераза I является также 3' → 5'-экзонуклеазой (рис. 24.28). Удаляемый нуклеотид должен иметь свободный 3'-ОН-конец и не должен находиться в составе двойной спирали. Является ли такая экзонуклеазная активность фермента нежелательным побочным эффектом, или она каким-то образом участвует в биологическом действии ДНК-по- лимеразы? Эксперименты с использованием химически синтезированных полинуклеотидов с некомплементарным остатком на конце затравки показали, что 3' → 5'-экзонуклеазная активность выполняет в процессе полимеризации функцию редактирования. Рассмотрим полимер, показанный на рис. 24.28, в котором последовательность остатков dT образует двойную спираль с более длинным полимером dA. На З'-конце этой poly(dT)-последовательности имеется один остаток dC, который не образует водородных связей, так как он не комплементарен dA. При добавлении ДНК-полимеразы и dTTP этот некомплементарный остаток dC отщепляется раньше, чем начинается присоединение остатков dT. Эксперименты с использованием множества различных синтетических полимеров показали, что ДНК-полимераза I всегда удаляет некомплементарные остатки на конце затравки, прежде чем продолжать полимеризацию. Если на конце находится комплементарное основание и в среде присутствуют активированные предшественники, гидролиза практически не происходит. Полимеризация предотвращает гидролиз с 3'-конца.
Рис. 24.28. 3' → 5'-экзонуклеазная активность ДНК-полимеразы I
По всей вероятности, репликация ДНК идет с высокой точностью, так как спаривание оснований проверяется дважды. В тех случаях, когда пара оснований не вмещается в двойной спирали, полимеризация обычно не идет. Однако, если на этом этапе все-таки произойдет ошибка, она может быть исправлена раньше, чем будет присоединен следующий нуклеотид. Таким образом, ДНК-полимераза I проверяет результат каждого проведенного акта полимеризации, прежде чем перейти к следующему.
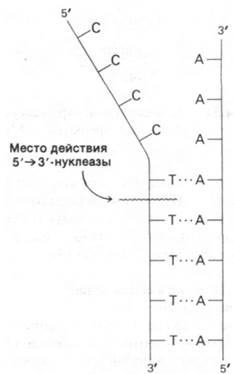
Кроме того, ДНК-полимераза I может гидролизовать ДНК, начиная с 5'-конца цепи. Эта 5' → 3'-нуклеазная активность (рис. 24.29) существенно отличается от обсуждавшейся выше 3' → 5'-экзонуклеазной активности. Во-первых, расщепляемая связь должна находиться в двухспиральном участке. Во-вторых, может происходить расщепление как концевой фосфодиэфирной связи, так и связи, расположенной на расстоянии нескольких нуклеотидов от 5'-конца (который может иметь свободную или фосфорилированную гидроксильную группу). В-третьих, 5' → 3'-нуклеазная активность увеличивается, если одновременно идет синтез ДНК. В-четвертых, активный участок 5' → 3'-нуклеазной активности четко отделен от активных участков полимеризации и 3' → 5'-гидролиза. ДНК- полимеразу I можно расщепить протеолитическими ферментами на фрагмент с массой 36 кДа, содержащий всю 5' → 3'-нуклеазную активность, и фрагмент с массой 75 кДа, содержащий всю полимеразную и всю 3' → 5'-экзонуклеазную активности. Таким образом, ДНК-полимераза I содержит по меньшей мере два различных фермента в одной полипептидной цепи. 5' → 3'-нуклеаза дополняет 3' → 5'-экзонуклеазную активность, исправляя ошибки другого рода. Например, 5' →3'-нуклеаза участвует в вырезании пиримидиновых димеров, образующихся при облучении ДНК ультрафиолетом (разд. 24.24). Более того, 5' → 3'-нуклеазная активность играет ключевую роль в самой репликации ДНК (разд. 24.19).
Рис. 24.29. 5' → 3'-нуклеазная активность ДНК-полимеразы I
24.15. ДНК-лигаза соединяет фрагменты ДНК
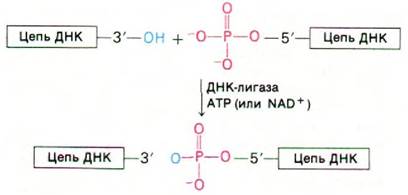
ДНК-полимераза I может присоединять дезоксирибонуклеотиды к затравочной цепи, но она не способна катализировать соединение двух цепей ДНК или замыкание одной цепи ДНК. Обнаружение кольцевой ДНК указывало, что такой фермент должен существовать. В 1967 г. в нескольких лабораториях одновременно была открыта ДНК-лигаза - фермент, катализирующий образование фосфодиэфирной связи между двумя цепями ДНК (рис. 24.30). Фермент этот активен при наличии свободной ОН-группы на 3-конце одной цепи ДНК и фосфатной группы на 5'-конце другой. Образование фосфодиэфирной связи между этими группами - эндергоническая реакция. Следовательно, для реакции соединения цепей требуется источник энергии. У Е. coli и других бактерий эту роль выполняет NAD +, тогда как в клетках животных и зараженных бактериофагом клетках данная реакция осуществляется за счет энергии АТР.
Рис. 24.30. ДНК -лигаза катализирует соединение двух цепей ДНК, входящих в состав одной двухспиральной молекулы
Заслуживает внимания и еще один аспект работы ДНК-лигазы: ДНК-лигаза не может соединить две молекулы одноцепочечной ДНК. Цепи ДНК, соединяемые ДНК-лигазой, должны быть частью двухцепочечной молекулы ДНК. Исследования модельных систем дают основание думать, что ДНК-лигаза образует фосфодиэфирную связь только в том случае, если вблизи от места разрыва имеется хотя бы несколько пар оснований. В действительности ДНК-лигаза заделывает одноцепочечные разрывы в остове двухспиральной ДНК. Этот процесс необходим для нормального синтеза ДНК, для репарации, поврежденной ДНК, и для сращивания (сплайсинга) цепей ДНК при генетической рекомбинации.
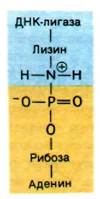
Рассмотрим механизм этой реакции, установленный Робертом Леманом (Robert Lehman). ATP или NAD+ вступают в реакцию с ДНК-лигазой и образуют ковалентный комплекс фермент-AMP, в котором AMP связан с ε-аминогруппой лизинового остатка фермента фосфоамидной связью (рис. 24.31). Остаток AMP активирует фосфатную группу на 5'-конце ДНК. Последняя стадия - нуклеофильная атака активированного атома фосфора 3'-ОН-группой. В результате образуется фосфодиэфирная связь и освобождается AMP. Движущая сила этой последовательности реакций - гидролиз пирофосфата, отщепляющегося при образовании комплекса фермент—аденилат. Таким образом, на образование фосфодиэфирной связи в остове ДНК расходуются две богатые энергией фосфатные связи, если источником энергии служит АТР.
Рис. 24.31. Ковалентный промежуточный комплекс фермент—AMP