БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
ЧАСТЬ V. МОЛЕКУЛЯРНАЯ ФИЗИОЛОГИЯ
ГЛАВА 33. ИММУНОГЛОБУЛИНЫ
33.5. При ферментативном расщеплении иммуноглобулина G образуются активные фрагменты
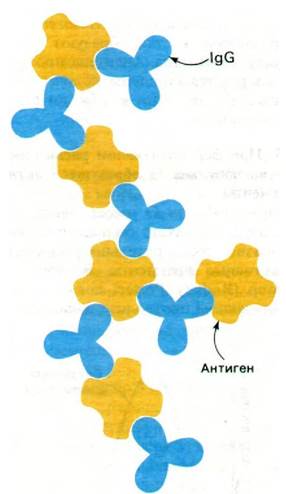
Иммуноглобулин G имеет массу 150 кДа. При изучении такого большого белка целесообразно предварительно расщепить его на активные фрагменты. В 1959 г. Родни Портер (Rodney Porter) показал, что при ограниченном протеолизе папаином иммуноглобулин G расщепляется на три активных фрагмента массой по 50 кДа. Два фрагмента связывают антиген. Их обозначили Fab (ab - от англ. antigen binding - связывающий антиген, F - от англ. fragment - фрагмент), каждый из Fbсодержит по одному участку связывания гаптена или антигена, причем по связывающему сродству этот участок не отличается от всей молекулы в целом. Однако, будучи одновалентным (т.е. имея один участок связывания), Fbне дает осадка с антигеном; этим Fabотличается от интактной молекулы иммуноглобулина G, содержащей два идентичных участка связывания антигена. Иммуноглобулин G может дать осадок с антигеном, содержащим не одну, а несколько антигенных детерминант. При этом формируется структура в виде протяженной решетки, где каждая молекула антитела образует перекрестные связи с двумя и более антигенами и наоборот (рис. 33.8). Осадок достигает наибольшего размера, если антитело и антиген присутствуют в эквивалентных количествах.
Рис. 33.6. Флуоресценция ε-дансиллизина отчетливо меняется при связывании этого гаптена со специфическими антителами. Сдвиг максимума флуоресценции в сторону более коротких волн и увеличение интенсивности флуоресценции свидетельствуют о том, что связывание гаптена происходит в неполярном участке
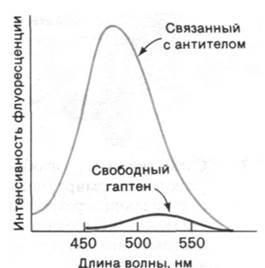
Рис. 33.7. Протеолитическое расщепление иммуноглобулина G (IgG)
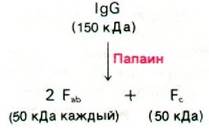
Рис. 33.8. Схематическое изображение решетки, формирующейся при образовании перекрестных связей между IgG (показано синим цветом) и антигеном (показано желтым цветом)
Третий фрагмент (также 50 кДа), обозначаемый Fc, не способен к связыванию антигена, но обладает другими биологически важными функциями. В отличие от Fab этот фрагмент способен проникать через плацентарную мембрану. Следовательно, способность иммуноглобулина G проходить сквозь плаценту и попадать в систему кровообращения плода определяется наличием на Fcспецифического участка, обеспечивающего перенос через плаценту. На Fcимеется также участок связывания комплемента. Связывание антитела с антигенной детерминантой на поверхности чужеродной клетки часто ведет к лизису последней. Такой результат взаимодействия антитела с антигеном опосредован группой белков, носящих общее название комплемент. Присоединение одного из этих белков к комплексу антиген—антитело и запускает последовательность реакций, приводящих к лизису чужеродной клетки. В обозначении фрагмента Fc индекс «с» (от англ. cristallizable - кристаллизуемый) указывает на способность этого фрагмента кристаллизоваться, Обнаружение этого свойства послужило первым указанием на гомогенность Fc; что касается фрагментов Fab, то они гетерогенны и обычно не кристаллизуются.
33.6. Иммуноглобулин G состоит из L- и Н-цепей
Следующий важный шаг в развитии иммунологии был сделан также в 1959 г., когда Джералду Эделману (Gerald Edelman) удалось показать, что иммуноглобулин G состоит из полипептидных цепей двух видов. Белок обрабатывали следующим образом: дисульфидные мостики в молекуле восстанавливали меркаптоэтанолом; далее разрушали нековалентные связи 6 М раствором мочевины. При хроматографическом анализе смеси было обнаружено, что иммуноглобулин состоит из полипептидных цепей массой 25 и 50 кДа, обозначенных соответственно, как легкие (L) и тяжелые (Н) цепи.
Впоследствии Портер подобрал более мягкие условия обработки, позволившие реконструировать иммуноглобулин G из двух Н- и двух L-пепей. На основе этих исследований он предложил модель (рис. 33.9) субъединичной структуры иммуноглобулина G, в соответствии с которой каждая L-цепь соединена с Н-цепью дисульфидной связью. Н-цепи, кроме того, связаны между собой по крайней мере одной дисульфидной связью. В целом субъединичная структура иммуноглобулина G L2H2.
Рис. 33.9. Субъединичная структура IgG—L2H2. Fab-фрагменты, высвобождающиеся при расщеплении папаином, показаны синим цветом, Fс-фрагмент - красным
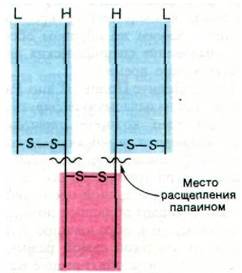
Далее удалось определить, какие участки предложенной структуры соответствуют фрагментам, образующимся при расщеплении папаином. Папаин отщепляет Н-цепи со стороны С-конца от дисульфидного мостика, соединяющего L- и Н-цепи. В итоге Fab состоит из целой L-цепи и аминоконцевой половины Н-цепи, тогда как Fc состоит из С-концевых половин обеих Н-цепей, Часть Н-цепи, содержащаяся в Fab, обозначается Fd.
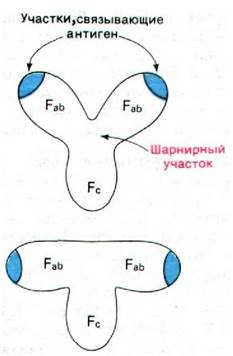
33.7. Иммуноглобулин G - гибкая Y-образная молекула
Электронно-микроскопические исследования, проведенные Робином Валентайном и Майклом Грином (Robin Valentine, Michael Green), показали, что иммуноглобулин G имеет форму буквы Y и что гаптен присоединяется на концах Fab-единиц. Fс-единица и две Fab-единицы в интактном антителе соединены между собой своего рода шарниром, благодаря чему угол между Fab-единицами может меняться быстро и в большом диапазоне величин (рис. 33.10). Этот вид подвижности (гибкости) шарнирного типа усиливает комплексообразование между антигеном и антителом, так как способствует лучшему связыванию поливалентных антигенов. В самом деле, таким путем расстояние между антигенсвязывающими участками на концах Fab-единиц может быть приведено в соответствие с расстоянием между специфическими детерминантами на антигене (например, на вирусе, имеющем много повторяющихся субъединиц). Как правило, если связывание поливалентного антигена происходит в двух участках связывания антигена, то сродство возрастает в 104 раз по сравнению со связыванием в одном участке. Не исключено, что подвижность шарнирного типа играет также определенную роль и в передаче информации от Fab-единиц на Fс-единицу.
Рис. 33.10. Иммуноглобулин в имеет У-образную форму. Наличие в молекуле шарнирного соединения обусловливает подвижность отдельных участков