БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
ЧАСТЬ V. МОЛЕКУЛЯРНАЯ ФИЗИОЛОГИЯ
ГЛАВА 34. МЫШЕЧНОЕ СОКРАЩЕНИЕ И ПОДВИЖНОСТЬ КЛЕТОК
34.2. При мышечном сокращении происходит скольжение толстых и тонких нитей относительно друг друга
Когда мышца сокращается, степень ее укорочения может достигнуть 1/3 первоначальной длины. С чем это связано? В 50-х годах две группы исследователей независимо друг от друга постулировали, исходя из данных дифракции рентгеновских лучей, световой и электронной микроскопии, модель мышечного сокращения, получившую название модель скользящих нитей. Основные черты этой модели (рис. 34.6), выдвинутой Эндрью Хаксли и Р. Нидергерке (Andrew Huxley, R. Niedergerke), а также Хью Хаксли и Джейн Хенсон (HughHuxley, Jean Hanson), заключаются в следующем.
Рис. 34.6. Модель скользящих нитей
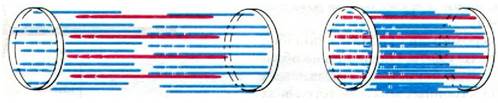
1. Длина как толстых, так и тонких нитей в ходе мышечного сокращения не меняется.
2. В то же время длина саркомера при сокращении уменьшается вследствие того, что нити двух типов перекрываются в большей степени, а именно в ходе сокращения толстые и тонкие нити скользят относительно друг друга.
3. Сила сокращения генерируется в результате активного движения нитей одного типа вдоль прилегающих нитей другого типа.
В пользу этой модели свидетельствуют данные, полученные при измерении длины А- и I-дисков, а также зоны Н в растянутой, покоящейся и сократившейся мышце (рис. 34.6). А-диск характеризуется постоянной длиной, т. е. размер толстых нитей при сокращении не меняется. Расстояние между Z-пластинкой и началом ближайшей к ней зоны Н также постоянно; следовательно, и размер тонких нитей не меняется при сокращении. Однако зона Н и I-диск при сокращении становятся уже, поскольку в сократившемся волокне толстые и тонкие нити перекрываются в большей мере, чем в покоящейся мышце.
34.3. Миозин образует толстые нити; он гидролизует АТР и связывает актин
Миозин обладает тремя биологически важными функциями. Во-первых, при физиологических значениях ионной силы и рН молекулы миозина в растворе спонтанно образуют волокна. По существу, толстые нити миофибрилл состоят в основном из молекул миозина. Во-вторых, миозин - это фермент. В 1939г. В. А. Энгельгардт и М. Н. Любимова обнаружили, что миозин обладает АТР-азной активностью:
АТР + Н20 ⇄ АDР + Рi + Н+
Эта реакция является непосредственным источником свободной энергии, необходимой для мышечного сокращения. В-третьих, миозин связывает полимеризованную форму актина - основного компонента тонких нитей. Именно это взаимодействие играет ключевую роль в генерировании силы, обеспечивающей смещение толстых и тонких нитей относительно друг друга.
Молекула миозина очень большая (500 кДа). Она состоит из двух идентичных основных цепей (по 200 кДа) и четырех легких цепей (примерно по 20 кДа). На электронных микрофотографиях видно, что миозин состоит из глобулярной, образующей две головки части, присоединенной к очень длинному стержню (рис. 34.7 и 34.8). Стержень представляет собой двухцепочечную α-спирализованную суперспираль.
Рис. 34.7. Электронная микрофотография молекулы миозина

Рис. 34.8. Схематическое изображение молекулы миозина

34.4. Миозин можно расщепить на активные фрагменты
Если миозин подвергнуть ферментативному расщеплению, то образуются фрагменты, сохраняющие некоторые функции интактной молекулы. Выше на примере иммуноглобулинов (разд. 33.5) уже было показано, насколько плодотворен такой экспериментальный подход при изучении макромолекул. На самом же деле этот подход был разработан для миозина раньше, чем для иммуноглобулинов. В 1953 г. Эндрью Сент- Дьёрдьи (Andrew Szent Gyorgyi) показал, что при обработке трипсином миозин расщепляется на два фрагмента, названные им легким меромиозином и тяжелым меромиозином (рис. 34.9).
Рис. 34.9. Ферментативное расщепление миозина. На схеме не показаны 4 легкие цепи
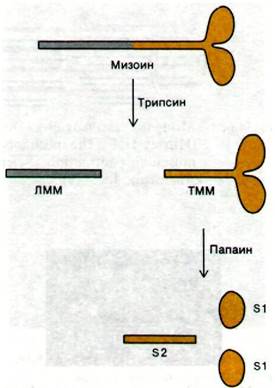
Легкий меромиозин (ЛММ), подобно миозину, образует нити. Однако он не обладает АТР-азной активностью и не связывает актина. На электронных микрофотографиях видно, что ЛММ имеет форму стержня; удлиненность структуры обусловливает высокую вязкость растворов ЛММ. Данные определения оптического вращения показали, что 90% молекулы ЛММ имеет структуру α-спирали. Это подтверждалось и при анализе дифракции рентгеновских лучей; волокна ЛММ дают сильный рефлекс при 5,1 А, характерный для а-спирализованных суперспиралей. В целом, как было установлено, ЛММ представляет собой двухцепочечный а-спирализованный стержень длиной 850 А.
Тяжелый меромиозин (ТММ) обладает совершенно иными свойствами. ТММ катализирует гидролиз АТР и связывает актин, но не способен к образованию волокон. ТММ состоит из вытянутой стержневидной части и глобулярной (в виде двух головок) области (рис. 34.9). При дальнейшем ферментативном расщеплении ТММ распадается на два глобулярных субфрагмента (обозначаемых S1) и один фибриллярный субфрагмент S2). Каждый S1-фрагмент имеет участок с АТР-азной активностью и участок связывания актина. Кроме того, к S1-фрагменту присоединены легкие цепи миозина. Легкие цепи способны модулировать АТР-азную активность миозина. Так, например, в гладких мышцах ими опосредовано регулирующее действие Са2+ на сокращение.