БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
ЧАСТЬ V. МОЛЕКУЛЯРНАЯ ФИЗИОЛОГИЯ
ГЛАВА 34. МЫШЕЧНОЕ СОКРАЩЕНИЕ И ПОДВИЖНОСТЬ КЛЕТОК
34.9. «Рабочим ходом» является поворот связанной с актином S1-головки миозина
Генерирование силы сокращения связано с циклическим образованием и диссоциацией комплекса между 81-головкой миозина и актином. Циклически повторяющиеся процессы присоединения, подтягивания и отсоединения сопровождают даже одиночное сокращение. Механизм генерирования силы сокращения изучается в настоящее время методами биохимии, электронной микроскопии, дифракции рентгеновских лучей. Полученные данные показывают, что в покоящейся мышце головки S1 не связаны с тонкими нитями (рис. 34.17, А). В этом физиологическом состоянии головки S1 располагаются вокруг толстой нити по спирали. При стимуляции мышцы S1-головки отодвигаются от толстых нитей и прикрепляются к актиновым единицам на тонких нитях (рис. 34.17, Б). На следующем этапе головки S1 меняют свое направление так, что их длинная ось образует угол примерно 45° с осью тонких нитей (рис. 34.17, В). Этот постулированный поворот головок миозина является, по-видимому, рабочим ходом мышечного сокращения. Через S2-единицу миозина поворот S1-домена передается на толстую нить. В итоге толстая нить продвигается относительно тонкой примерно на 75 А. Завершающий этап процесса - отсоединение S1-головки от тонких нитей (рис. 34.17, I).
Рис. 34.17. Предполагаемый механизм генерирования силы при взаимодействии S1-головок нитей миозина с нитями актина. Поворот головки S1, связанной с актином, вызывает движение толстых нитей относительно тонких (на схеме - переход от Б к В)
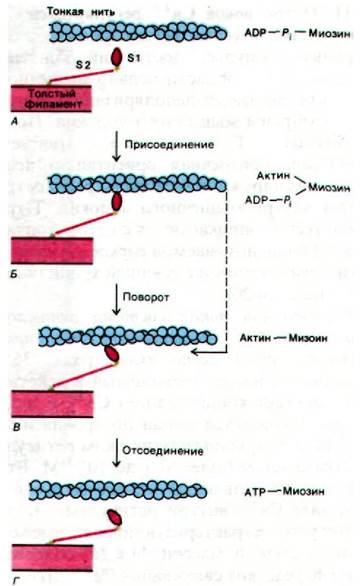
Сопоставим эти предполагаемые структурные переходы, обеспечивающие возникновение силы сокращения, с промежуточными этапами гидролиза АТР. В состоянии покоя миозин содержит прочно связанные ADP и Рi (рис. 34.17, А). При стимуляции мышечного волокна головка S1 присоединяется к тонкой нити в перпендикулярном ей направлении (рис. 34.17, Б). Далее ADP и Рi связанные с S1, высвобождаются, а головка S1 совершает поворот, принимая наклонное положение по отношению к тонкой нити (рис. 34.17, В). Таким образом, «рабочий ход» обеспечивается высвобождением прочно связанных ADP и Pi. На следующем этапе происходит отделение головки S1 от тонкой нити вследствие связывания АТР (рис. 34.17, I). Далее отсоединенная от актина головка S1 вновь становится около тонкой нити перпендикулярно ей. Завершающий этап цикла - гидролиз АТР головкой S1, не связанной с актином.
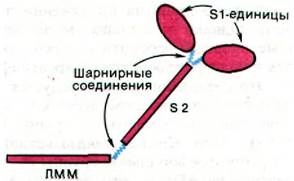
В молекуле миозина имеется два типа шарнирных соединений, благодаря которым головка S1 обратимо присоединяется к актину или отсоединяется от него, а также, находясь в связанном с актином состоянии, меняет свое направление. Шарнир одного типа локализован между каждой из головок S1 и стержнем S2, а шарнир второго типа - между S2 и ЛММ-единицей миозина (рис. 34.18). Шарниры представляют собой гибкие участки полипептидной цепи, легко расщепляемые гидролитическими ферментами. Собственно, сам факт ферментативного расшепления миозина на фрагменты ЛММ, S1 и S2 указывает на то, что миозин образован из доменов, соединенных между собой шарнирными участками. Функция домена S2 состоит в передаче напряжения от связанной с тонкой нитью головки S1 на домен ЛММ, составляющий часть толстой нити. Благодаря шарнирному участку между S1 и S2 головка S1 может по- разному взаимодействовать с актином в зависимости от того, имеются ли на ней прочно связанные ADP и Рi или нет. Другой шарнирный участок, соединяющий S2 и ЛММ, допускает довольно большие изменения в положении S1 относительно толстой нити и тем самым обеспечивает точность взаимодействия S1 с актином. В итоге напряжение может генерироваться на большом протяжении латеральных поверхностей толстых и тонких нитей. В целом сегментарная подвижность (гибкость) шарнирного типа играет критическую роль в мышечном сокращении, так же, как и в механизме действия антител (разд. 33.7).
Рис. 34.18. Два типа шарнирных соединений в миозине - один между S1 и S2, второй между S2 и ЛММ - позволяют изменять положение головки S1 по отношению к актину во время «рабочего хода»
34.10. Тропонин и тропомиозин опосредуют регуляторное действие ионов кальция на мышечное сокращение
Физиологическим регулятором мышечного сокращения служит Са2+. Сетсуро Эбаши (Setsuro Ebashi) открыл, что влияние Са2+ на взаимодействие актина и миозина опосредовано тропомиозином и тропониновым комплексом, которые локализованы в тонких нитях и составляют около трети их массы. Тропомиозин представляет собой двухцепочечный α-спирализованный тяж. Этот очень сильно вытянутый белок массой 70 кДа располагается почти параллельно длинной оси тонкой нити (рис. 34.19). Тропонин - комплекс трех полипептидных цепей: ТнС (18 кДа), ТнI (24 кДа) и ТнТ (37 кДа). ТнС связывает ионы кальция, ТнI связывается с актином, а ТнТ - с тропомиозином. Тропониновые комплексы расположены на тонких нитях на расстоянии 385 А друг от друга, причем этот интервал задается длиной тропомиозина. Тропониновый комплекс, связанный с одной молекулой тропомиозина, регулирует активность примерно 7 мономеров актина.
Рис. 34.19. Предполагаемая структура тонкой нити в состоянии покоя. Двойная спираль тропомиозина (показано красным цветом) блокирует участки актина (синий цвет), в которых при сокращении происходит связывание S1-головок миозина. Присоединение Са2+ к ТнС-компо- ненту тропонинового комплекса (показано желтым цветом) вызывает смещение спирали тропомиозина, при этом открываются участки связывания головок S1 на актине, и в итоге происходит сокращение
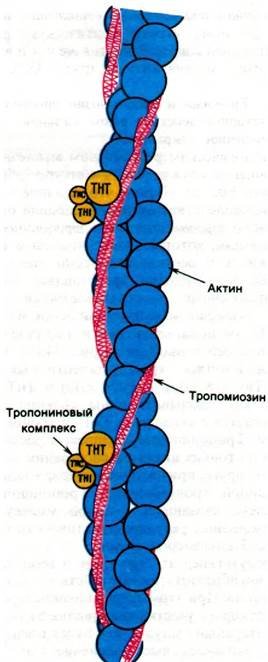
В отсутствие Са2+ тропонин и тропомиозин ингибируют взаимодействие актина и миозина. При этом тропомиозин стерически блокирует участки связывания S1 на актине. Нервный импульс, как будет показано ниже, запускает высвобождение Са2+ из саркоплазматического ретикулума.
Высвобожденный Са2+ связывается с ТнС- компонентом тропонина, что вызывает конформационные сдвиги, передающиеся на тропомиозин и затем на актин. В частности, тропомиозин передвигается к центру длинной впадины, идущей спирально вдоль тонкой нити. Это разрешает взаимодействие S1-головок миозина с актиновыми единицами тонких нитей. Возникает сила сокращения и одновременно гидролизуется АТР; далее происходит удаление Са2+, и тропомиозин вновь блокирует доступ актина к S1-головкам миозина. Таким образом, Са2+ регулирует мышечное сокращение по аллостерическому механизму со следующей последовательностью передачи информации:
Са2 + → Тропонин → Тропомиозин → Актин → Миозин.
34.11. Поток ионов Са2+ регулируется саркоплазматическим ретикулумом
Нервный импульс, достигший концевой пластинки, т.е. области нервно-мышечного контакта, вызывает деполяризацию наружной мембраны мышечного волокна. По Т- трубочкам (Т от англ. transverse orientation - поперечная ориентация) деполяризация наружной мембраны распространяется внутрь мышечного волокна. Т-трубочки тесно соприкасаются с сетью тончайших каналов, называемой саркоплазматическим ретикулумом и служащей хранилищем Са2+ (рис. 34.20).
Рис. 34.20. Схематическое изображение саркоплазматического ретикулума
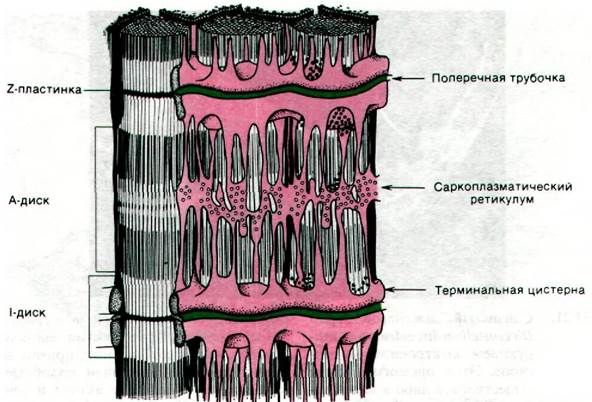
В состоянии покоя система активного транспорта Са2+ накапливает его в саркоплазматическом ретикулуме (разд. 36.9). Кальциевый насос, приводимый в действие АТР, снижает концентрацию Са2+ в цитоплазме покоящихся мышц до уровня ниже 10-6 М, а в саркоплазматическом ретикулуме повышает ее более чем до 10-3 М. Второй белок, названный кальсеквестрином, связывает Са2+ внутри ретикулума. Кальсеквестрин, характеризующийся высокой кислотностью и массой 44 кДа, содержит более 40 участков связывания Са2+. Деполяризация мембран Т-трубочек вызывает выброс Са2+ из цистерн саркоплазматического ретикулума. Высвобожденный Са2+ связывается с ТнС-компонентом тропонинового комплекса и стимулирует мышечное сокращение, как это было описано выше.
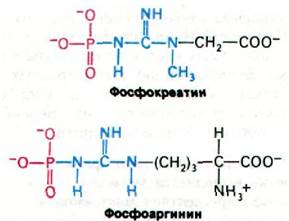
34.12. Фосфокреатин - форма запасания ~Р
То количество АТР, которое имеется в мышце, может поддержать сократительную активность всего лишь на протяжении доли секунды. Однако в мышцах позвоночных богатые энергией фосфатные связи запасаются в виде фосфокреатина (креатинфосфата). Это соединение характеризуется более высоким потенциалом переноса высокоэнергетических фосфатных групп, чем АТР (разд. 11.6). Креатинкиназа катализирует перенос фосфорильной группы от фос- фокреатина на ADP с образованием АТР:
Фосфокрсатин + ADP АТР + Креатин.
Некоторые беспозвоночные для накопления высокоэнергетических фосфорильных групп используют фосфоаргинин. Фосфокреатин и фосфоаргинин называют фосфагенами.
В работающей мышце запас фосфокреатина быстро истощается, а, следовательно, снижается и содержание АТР. При этом возрастает концентрация ADP и Pi а также - под действием аденилаткиназы (миокиназы) - содержание AMP:
2ADP ⇄ АТР + AMP.
Понижение энергетического заряда приводит к стимуляции гликолиза, цикла трикарбоновых кислот и окислительного фосфорилирования (разд. 14.13) в работающей мышце. Относительный вклад каждого из этих процессов в генерирование АТР зависит от типа мышц. Так, в красных мышцах, цвет которых обусловлен высоким содержанием миоглобина и цитохромов дыхательной цепи, уровень аэробного обмена намного выше, чем в белых мышцах.